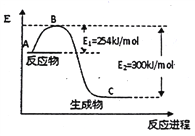
-
在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g)
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____(填“加快”“减慢”“无影响”), 理由是_______________________________________________________________.
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______.(填“加快”“减慢”“无影响”) 理由是________________________________________________.
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____.(填“加快”“减慢”“无影响”) 理由是_____________________________________________.
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______.(填“加快”“减慢”“无影响”) 理由是____________________________________________.
(5)提高起始的反应温度,反应速率______.(填“加快”“减慢”“无影响”) 理由是_________________________.
难度: 中等查看答案及解析
-
I、氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2 H2 ( g ) +O2 ( g )=2H2O ( g ) ΔH = -483.6 kJ/mol
N2 ( g ) +2O2 ( g )=2NO2 ( g ) ΔH = + 67.7 kJ/mol
则H2将NO2还原为N2的热化学反应方程式:___________________________
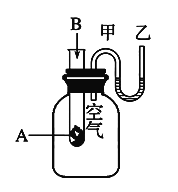
II、为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为_____(填“放热”或“吸热”)反应。ΔH___0(填>、<、=)
(2)A和B的总能量比C和D的总能量_____(填“高”或“低”)。
(3)物质中的______能通过化学反应转化成______能释放出来。
(4)反应物化学键断裂吸收的能量_____(填“高”或“低”)于生成物化学键形成放出的能量。
难度: 中等查看答案及解析
-
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
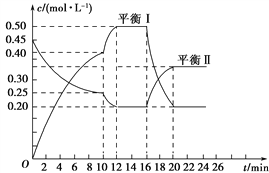
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
难度: 困难查看答案及解析