-
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。我市已将PM2.5列入空气质量播报指标。下列有关说法中不正确的是( )
A.空气中PM2.5含量较高时,容易引起呼吸系统疾病
B.国家应该大力开发和使用太阳能、风能、天然气等可再生能源来降低环境污染
C.PM2.5的颗粒在空气中不一定能形成气溶胶
D.研制开发燃料电池汽车,减少机动车尾气排放,某种程度可以减少空气中PM2.5含量
难度: 简单查看答案及解析
-
科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
NaHCO3+H2
HCOONa+H2O,下列有关说法不正确的是( )
A.储氢、释氢过程均有能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
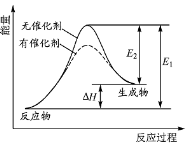
A.该反应为放热反应
B.该反应焓变可表示为△H=-(E1-E2)kJ·mol-1
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
难度: 中等查看答案及解析
-
下列有关热化学方程式的评价合理的是( )
实验事实
热化学方程式
评价
A
已知H+(aq)+OH-(aq)=H2O(l)
△H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合
H2SO4(aq)+Ba(OH)2(aq)
=BaSO4(s)+ 2H2O(l)
△H=-114.6 kJ·mol-1
正确
B
醋酸与稀氢氧化钠溶液混合
CH3COOH(aq)+NaOH(aq)
=CH3COONa(aq)+H2O(l)
△H=-57.3kJ·mol-1
不正确;因为醋酸状态为“aq”,而不是“l”。
C
160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ
SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1
不正确;因为反应热为△H=-260.6kJ·mol-1
D
已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ
C(s)+O2(g)=CO2(g)
△H=-393.51 kJ·mol-1
不正确;同素异形体要注名称:C(石墨)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)
H2O(l) 的 ΔH = —40.69 kJ·mol-1
B.在25℃、101kPa,2mol S的燃烧热是1mol S的燃烧热2倍
C.CH4(g) +2O2(g) = CO2(g) +2H2O(g) ΔH=-akJ·mol-1 ,这里ΔH代表燃烧热
D.已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应
的ΔH为-384 kJ·mol-1
难度: 中等查看答案及解析
-
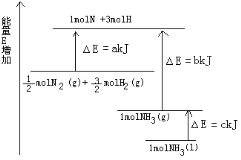
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
A.Q1=2Q2=92.4 B.92.4 >Ql>2Q2 C.92.4=Q1>2Q2 D.92.4 >Q1=2Q2
难度: 中等查看答案及解析
-
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
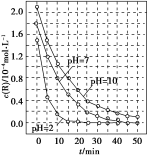
A.在0-50 min之间, pH = 2和PH = 7时R的降解百分率不相等
B.在 20-25 min之间, pH = 10 时R的平均降解速率为0.04 mol•L-1•min-1
C.溶液酸性越强, R 的降解速率越小
D.R的起始浓度和溶液的PH均影响R的降解速率
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是( )
A.增大压强 B.减少B的浓度 C.减少A的浓度 D.升高温度
难度: 中等查看答案及解析
-
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
A.A的平均反应速率为0.15 mol•L-1•min-1
B.平衡时,C的浓度为0.25mol•L-1
C.B的平均反应速率为0.1 mol•L-1•min-1
D.平衡时,容器内压强为原来的0.875倍
难度: 中等查看答案及解析
-
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1
B.容器中发生的反应可表示为:3X(g)+Y(g) = 2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
难度: 中等查看答案及解析
-
一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
A.②③④⑥ B.③⑥⑦ C.②③⑥ D.③⑥
难度: 中等查看答案及解析
-
加热N2O5时,发生以下两个反应:N2O5
N2O3 + O2,N2O3
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol•L-1,c(N2O3) 为1.62mol•L-1,则c(N2O5) 为( )
A.1.44mol•L-1 B.3.48mol•L-1 C.0.94mol•L-1 D.1.98mol•L-1
难度: 中等查看答案及解析
-
下列事实能用勒沙特列原理解释的是( )
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制
取金属钾Na(l)+ KCl(l)
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A.②③⑤ B.①③⑤ C.①②③④⑤ D.①②③⑤
难度: 中等查看答案及解析
-
某温度下,在一容积不变的密闭容器中,反应A(g) + 2B (g)
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
A.向左移动 B.向右移动 C.不移动 D.无法判断
难度: 中等查看答案及解析
-
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
A.反应速率:乙>甲 B.平衡混合物中SO2的体积分数:乙>甲
C.SO2的转化率:乙>甲 D.平衡时O2的浓度:乙>甲
难度: 中等查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D.容器Ⅰ、Ⅲ中反应的平衡常数相同
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g)ΔH同时符合下列两图中各曲线的规律的( )
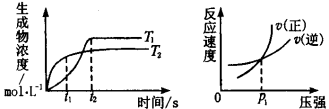
A.a+b>c+d T1<T2 ΔH<0
B.a+b>c+d T1<T2 ΔH>0
C.a+b<c+d T1>T2 ΔH<0
D.a+b>c+d T1>T2 ΔH>0
难度: 中等查看答案及解析
-
在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)
4C(g),达平衡时c(A)=1.00mol•L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol•L-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=
难度: 中等查看答案及解析