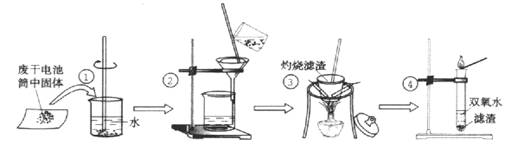
-
绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列符合绿色化学实验的是( )
A.用铜与浓硫酸反应制取CuSO4,并用少量品红溶液吸收尾气
B.将CO还原Fe2O3后的尾气直接排入空气中
C.用CCl4完成萃取操作练习时,将溴水改成碘水
D.将Zn和稀硫酸制H2后的废液倒入水槽后再清洗玻璃仪器
难度: 中等查看答案及解析
-
起固定氮作用的化学反应是 ( )
A.N2与H2在一定条件下反应生成NH3
B.NO与O2反应生成NO2
C.由NH3制NH4HCO3和(NH4)2SO4
D.NH3经催化氧化生成NO
难度: 简单查看答案及解析
-
下列现象或事实可用同一原理解释的是( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
C.漂白粉和水玻璃长期暴露在空气中变质
D.常温下铁分别加入浓硫酸和浓硝酸中均无明显现象
难度: 简单查看答案及解析
-
如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
难度: 简单查看答案及解析
-
下列对实验现象的预测不正确的是( )
A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
B.向氢氧化铁胶体中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊
难度: 简单查看答案及解析
-
根据相关的化学原理,下列判断正确的是( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C.若A2 + 2D— == 2A— + D2,则氧化性D2>A2
D.若R2—和M+的电子层结构相同,则离子半径R2—>M+
难度: 简单查看答案及解析
-
7.有a、b、c、d、e五种气体,进行下列实验:
(1)a和b混合
气体变红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入氢硫酸中
都产生淡黄色浑浊
a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
难度: 简单查看答案及解析
-
下列对有关化学反应过程或实验现象的解释中,正确的是( )
A.Cl2 的水溶液可以导电,说明Cl2 是电解质
B.在少量Fe(NO3)2试样的水溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液变成血红色,说明Fe(NO3)2试样已经变质
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2 的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
难度: 简单查看答案及解析
-
已知次碘酸(HIO)既能和酸发生中和反应又能和碱发生中和反应,它与盐酸反应将生成( )
A.IOCl B.ICl C.HI D.HClO
难度: 简单查看答案及解析
-
下列叙述中正确的是(NA为阿伏加德罗常数)( )
A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA
B.同温同压下,相同体积的物质,其物质的量必相等
C.5.3g Na2CO3固体含有的离子数为1.5NA
D.标准状况下,0.5 NA个Br2所占的体积约为11.2L
难度: 简单查看答案及解析
-
下列变化规律错误的是( )
A.微粒半径:F – < Cl – < Br – < I –B.稳定性:HI< HBr <HCl< HF
C.沸点:HF< HCl < HBr< HI D.阴离子还原性:F – < Cl – < Br – < I –
难度: 简单查看答案及解析
-
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出
的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D .FeS + 2H+ = Fe2+ + H2S↑
难度: 简单查看答案及解析
-
甲在常温时为离子晶体,由X、Y两种元素组成,在甲中Xm+和Yn–的电子层结构相同,甲、乙、丙、丁、戊之间有如下反应关系:( )
①甲+H2O H2↑+乙+丙↑
②H2 + 丙 丁(气体)
③乙+丙 甲+戊+H2O
④戊+丁 甲+己(酸性),则甲、戊、己依次是
A.NaCl、NaClO、HClO B.Na2S、Na2SO3、H2SO3
C.CaCl2、Ca(ClO)2、HClO D.K2S、K2SO3、H2SO4
难度: 简单查看答案及解析
-
下列各组气体等体积混合:①NO2和NO②NO2和O2③NO和N2,分别通入容积相同的a.b.c三支试管内(均充满),并立即倒立于盛水的水槽中,试管内水面上升高度的关系正确的是( )
A.a=b=c B.a>b>c C.b>c>a D.b>a>c
难度: 简单查看答案及解析
-
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推知该溶液中( )
A 一定含有I-,不能确定是否含有Cl- B 一定含有NO3-
C 不含有Fe3+,可能含有NO3- D 一定含有I-、NO3-和Cl-
难度: 简单查看答案及解析
-
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是 ( )
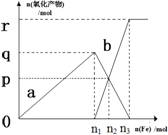
A.a是Fe(NO3)2 B.n1 = 0.375
C.p = 0.20 D.n2 = 0.30
难度: 简单查看答案及解析