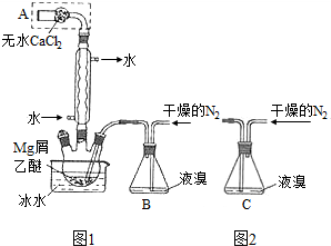
-
化学与生产、生活息息相关,下列叙述错误的是( )
A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.铁表面镀锌可增强其抗腐蚀性
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.制饭勺、饭盒、高压锅等的不锈钢是合金
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值.则下列有关叙述正确的是( )
A.1molFeI2与足量氯气反应时转移的电子数2 NA
B.在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA
C.7.8g过氧化钠用于呼吸面具中完全反应时转移电子总数为0.1 NA
D.将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA
难度: 简单查看答案及解析
-
下列关于实验的叙述正确的是( )
A. 实验室需用480mL、0.1mol/L的CuSO4溶液,应选用500mL容量瓶,称取12.5g胆矾
B. 酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后,需要用待测溶液润洗2-3次
C. 溶解固体溶质或稀释溶液时,未冷却至室温即转入容量瓶进行定容
D. 用标准浓度的NaOH 溶液滴定未知浓度的稀盐酸,碱式滴定管用蒸馏水润洗后不需要用标准溶液润洗2--3次
难度: 简单查看答案及解析
-
短周期元素a、b、c、d的原子序数依次增大,c、a、b最外层电子数为等差数列,公差为2,a、c的价电子数之和为6,d的核外电子数等于b的核外电子数加8。下列叙述错误的是( )
A. a和b可形成气态化合物
B. b和c形成的化合物为离子化合物
C. a和d最高价氧化物的水化物均呈酸性
D. c的原子半径小于d的原子半径
难度: 中等查看答案及解析
-
有机化合物9,10-二甲基菲的结构如图所示。其苯环上七氯代物的同分异构体有( )
A.8种 B.5种 C.4种 D.3种
难度: 简单查看答案及解析
-
根据下列实验,所得实验现象和实验结论正确的是( )
实验
现象
实验结论
A
将SO2气体通入紫色石蕊试液中
溶液先变红后褪色
二氧化硫具有酸性和漂白性
B
将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中
出现白色胶状沉淀
酸性: H2SO4﹥H2CO3﹥H2SiO3
C
将光亮的镁条放入盛有NH4Cl溶液的试管中
有大量气泡产生
反应中有NH3产生
D
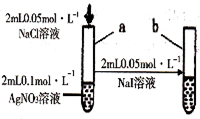
试管a出现白色沉淀,
试管b出现黄色沉淀
溶度积:Ksp(AgCl)﹥Ksp(AgI)
难度: 困难查看答案及解析
-
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点。其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用。已知POH =-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
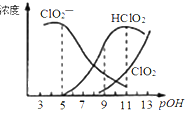
A.亚氯酸钠在碱性条件下较稳定
B.PH=7时,溶液中含氯微粒的浓度大小:c(ClO2—)﹥c(HClO2)﹥c (ClO2)
C.HClO2的电离平衡常数的数值Ka=10-6
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2—) + c(OH-)
难度: 困难查看答案及解析
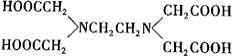
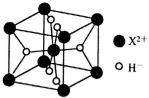
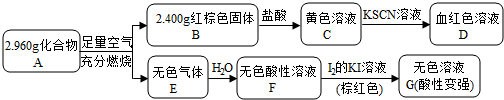
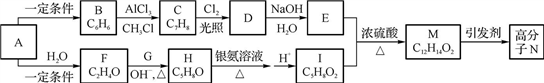
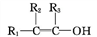
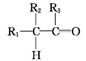
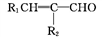 +H2O
+H2O