-
下列离子方程式正确的是
A.碳酸钡与盐酸反应 2H+ + BaCO3 = Ba2+ + H2O + CO2↑
B.氢氧化钡溶液与稀硫酸混合 Ba2+ + SO42- + H++ OH-= BaSO4↓+ H2O
C.氯气通入蒸馏水中 Cl2 + H2O = Cl- + ClO- +2 H+
D.CO2通入过量的澄清石灰水中 CO2 + Ca(OH)2 = CaCO3↓+ H2O
难度: 困难查看答案及解析
-
国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血.”这里的铁是指
A.铁单质 B.铁元素 C.四氧化三铁 D.硫酸铁
难度: 简单查看答案及解析
-
下图表示了x、y、z 事物间的从属关系,下列选项中不符合图中事物间从属关系的是
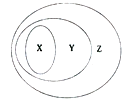
X
Y
Z
例
氧化物
化合物
纯净物
A
中和反应
复分解反应
化学反应
B
电解质
盐
化合物
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
难度: 中等查看答案及解析
-
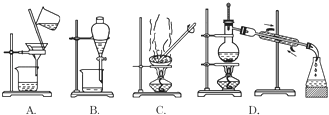
可以用下图所示装置收集并干燥的气体是
A. H2 B. NH3 C. Cl2 D. SO2
难度: 中等查看答案及解析
-
自2009年1月1日开始,我国起征燃油税。减少汽油等成品油的使用是这次税费改革的目的之一。下列说法不正确的是( )
A. 工业上将石油蒸馏得到汽油,发生了化学变化
B. 汽车尾气中的碳氢化合物会加剧温室效应
C. 汽车尾气的大量排放是形成光化学烟雾的重要原因
D. 汽车尾气中的“黑烟”会增加空气中固体颗粒的含量
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A. 用规格为10mL的量筒量取6.0mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管的底部
C. 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、SO32-、Cl-和Na+,若向其中通入足量的Cl2,溶液里上述四种离子的浓度基本保持不变的是( )
A. HCO3- B. SO32- C. Cl- D. Na+
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol N2所含有的原子数为NA
B. 标准状况下,16 g NH3中含有的分子数为NA
C. 标准状况下,22.4 L氯化氢所含的原子数为NA
D. 500 mL 1.0 mol·L-1硫酸钠溶液中所含的钠离子数为NA
难度: 简单查看答案及解析
-
用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,NaBH4+2H2O===NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A. NaBH4既是氧化剂又是还原剂 B. NaBH4是氧化剂,H2O是还原剂
C. 硼元素被氧化,氢元素被还原 D. 被氧化与被还原的元素质量比为1∶1
难度: 简单查看答案及解析
-
向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
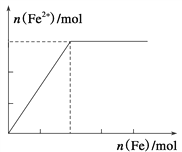
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
难度: 中等查看答案及解析
-
已知浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,浓H2SO4也可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3。由此可以确定上述有关物质氧化性由强到弱的顺序为 ( )
A. 浓H2SO4>Br2>Fe3+>Cu2+ B. 浓H2SO4>Cu2+>Fe3+>Br2
C. Br2>浓H2SO4>Fe3+>Cu2+ D. Fe3+>Cu2+>Br2>浓H2SO4
难度: 中等查看答案及解析
-
向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是( )
①a mol ②b mol ③
mol ④
mol ⑤0 mol ⑥(4a-b)mol
A. ①②④⑤⑥ B. ①④⑤⑥ C. ①②③⑤⑥ D. ①③⑤
难度: 困难查看答案及解析