-
比较下列各组化合物的沸点,前者低于后者的是( )
A. 乙醇和氯乙烷 B. 邻羟基苯甲酸与对羟基苯甲酸
C. 对羟基苯甲醛与邻羟基苯甲醛 D. H2O和H2Te
难度: 中等查看答案及解析
-
由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质改变 B.水分子中氢氧键缩短
C.水分子间的作用力减小 D.水分子间结构、物理性质改变
难度: 中等查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
元素代号
L
M
Q
R
T
原子半径
0.160 nm
0.143 nm
0.112 nm
0.104 nm
0.066 nm
主要化合价
+2
+3
+2
+6、-2
-2
A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
美国“海狼”号潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是( )
A. 原子半径:Al>Na
B. 第一电离能:Al>Na
C. 电负性:Na>Al
D. 基态原子未成对电子数:Na>Al
难度: 中等查看答案及解析
-
NH3和BF3可以通过配位键形成化合物NH3·BF3。下列说法正确的是
A. NH3、BF3两分子都是极性分子
B. NH3、BF3两分子的中心原子采取的都是sp3杂化
C. 形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道
D. 形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道
难度: 中等查看答案及解析
-
下列各组物质所含化学键类型完全相同的是
A.HNO3和NH4NO3 B.NaOH和KCl C.NaN3和CaO2 D.AlCl3和MgCl2
难度: 简单查看答案及解析
-
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
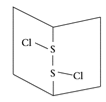
A. S2Cl2的电子式为
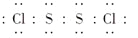
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O===SO2↑+3S↓+4HCl
难度: 简单查看答案及解析
-
下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是
A.H2O是一种非常稳定的化合物,这是由于氢键所致
B.氯化钠易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是 ( )。
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体
C.NH5的电子式为
D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
难度: 中等查看答案及解析
-
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
A.由极性键构成的极性分子 B.由非极性键构成的非极性分子
C.由非极性键构成的极性分子 D.由极性键构成的非极性分子
难度: 中等查看答案及解析
-
下列各组中的物质或离子都含配位键的是( )
A. H2O、Al2Cl6 B. CO2、SO42-
C. PCl5、[Co(NH3)4Cl2]Cl D. NH4Cl、[Cu(NH3)4]SO4
难度: 中等查看答案及解析
-
现代科学的发展使游离态的氮家庭又添新丁,据报道:意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A. N4属于一种新型的化合物 B. N4和N2互为同位素
C. N4与N2互为同素异形体 D. 1molN4气体转变为N2将吸收882kJ热量
难度: 简单查看答案及解析
-
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是
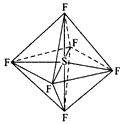
A. 六氟化硫不能燃烧
B. 六氟化硫中各原子均达到8电子稳定结构
C. 六氟化硫在水中的溶解度>六氟化硫在CS2中的溶解度
D. 六氟化硫分子是极性分子
难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
A
深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体
乙醇增强了溶剂的极性
B
用KSCN检验溶液中的Fe3+
Fe3+遇SCN-生成血红色沉淀
C
CH4的熔点低于CO2
碳氢键比碳氧键的键长短、键能大
D
氮原子的第一电离能大于氧原子
氮原子2p能级半充满
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A. C3H8中碳原子都采用的是sp3杂化
B. O2、CO2、N2都是非极性分子
C. 酸性:H2CO3<H3PO4<H2SO4<HClO
D. CO的一种等电子体为NO+,它的电子式为

难度: 中等查看答案及解析
-
下列说法中,正确的是
A. s区元素都是金属元素
B. p区元素全部都是非金属元素
C. d区、ds区和f区由副族元素组成
D. s区和p区由主族和0族元素组成
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 分子中共价键键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. N—N、N===N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能
难度: 简单查看答案及解析
-
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z基态原子的2p轨道上有3个未成对电子。下列说法正确的是
A.X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有12mol σ键
B.Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1
C.Y的气态氢化物分子中H—Y—H键角比Y的最高价氧化物分子中O—Y—O键角小
D.Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响
难度: 困难查看答案及解析
-
现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤气态双原子分子中肯定存在着
键,可能存在着π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
A.②③⑤ B.②⑥ C.③⑤ D.①④⑤
难度: 中等查看答案及解析
-
下列分子或离子中中心原子未用来成键的电子对最多的是
A. H2O B. NH3 C. NH4+ D. BCl3
难度: 简单查看答案及解析
-
关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
A. 中心原子的化合价为+2价 B. 配体为水分子,外界为Cl-
C. 配位数是6 D. 在其水溶液中加入AgNO3溶液,不产生白色沉淀
难度: 中等查看答案及解析