-
化学与生活密切相关,下列说法正确的是
A.淀粉、油脂和蛋白质都是高分子化合物
B.石油分馏是物理变化,可得到汽油、煤油等
C.医用酒精的浓度通常为95%
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 简单查看答案及解析
-
城市里发生的灾害和汽车尾气排放直接关联的是
A.雾霾 B.内河发臭 C.垃圾泛滥 D.噪音污染
难度: 简单查看答案及解析
-
下列装置工作时实现化学能转化为电能的是
A.干电池 B.光伏电池 C.离子交换膜电解槽 D.风力发电机
难度: 简单查看答案及解析
-
为了除去氯化镁酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,过
滤后再加入适量的盐酸。这种试剂是
A.氨水 B.氢氧化钠 C.碳酸镁 D.碳酸钠
难度: 中等查看答案及解析
-
现有①溴化钠溶液和溴水的混合溶液、②乙酸乙酯和乙酸钠溶液,分离它们的正确方法依次是
A.分液、蒸馏 B.蒸馏、分液 C.分液、萃取 D.萃取、分液
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A.NaCl的电子式为Na+:Cl:
B.钠离子的结构示意图

C.HCIO分子的结构式H—O—Cl
D.含78个中子的碘的放射性核素
I
难度: 中等查看答案及解析
-
属于非氧化还原反应的是
A.分解反应 B.复分解反应 C.吸热反应 D.银镜反应
难度: 中等查看答案及解析
-
下列数值最接近阿伏伽德罗常数的是
A.标准状况下22.4L乙醇中的分子数 B.48g臭氧中的原子数
C.常温常压下6mL水的原子数 D.1 L l mol/L氨水中的离子数
难度: 中等查看答案及解析
-
熔融状态可以导电的化合物是
A.CCl4 B.H2SO4 C.NaOH D.Hg
难度: 简单查看答案及解析
-
能用离子方程式CO32-+2 H+=H2 O+CO2↑表示的反应是
A.纯碱溶液中加入浓盐酸 B.小苏打溶液中加人稀硫酸
C.石灰石溶于稀硝酸 D.碳酸钾溶液中加入醋酸溶液
难度: 中等查看答案及解析
-
处于平衡状态的反应2 H2 S(g)
2H2(g)+S2(g)
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
难度: 中等查看答案及解析
-
新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2
Si3N4+6CO,下列就该反应的分析错误的是
A.压强增大,平衡向逆反应方向移动
B.SiO2是氧化剂,CO是氧化产物
C.上述反应若为放热反应,升高温度,平衡常数将减小
D.上述反应中每生成1 molSi3N4,氮元素得12mol电子
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是
A.金属钠投入蒸馏水2 Na+2H2O=2 Na+ +2OH- +H2↑
B.向亚硫酸钠溶液中加入足量硝酸SO3 2- +2 H+ =SO2↑+ H2O
C.用浓盐酸与MnO2反应制取少量氯气MnO2+4H++2C1- = Mn2+ + 2H2O+Cl2↑
D.硫酸亚铁溶液中加入酸化的双氧水Fe2++2H++H2O2 = Fe3++2H2O
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图:地壳中含量最大的三种元素已包含其中。关于这些元素的叙述不合理的是
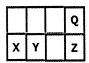
A.最高价氧化物对应水化物的酸性Z>Y
B.原子半径X>Y
C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液
D.元素Y的氧化物是形成酸雨的罪魁祸首
难度: 中等查看答案及解析
-
A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是

A.铝作负极,电池工作时将不断溶解
B.该电池不是二次电池,不可充电
C.碳纤维电极的电极反应是H2O2+2 e一+2H+ = 2 H2O
D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极
难度: 中等查看答案及解析
-
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
A.酸碱恰好中和 B.c1=c2
C.滴人酚酞溶液呈浅红色 D.所得溶液c(Na+)=c(CH3COO一)
难度: 中等查看答案及解析
-
下列各实验相应操作、实验现象及原因解释或推论合理的是
选项 操作 现象 解释或推论
A 铁片投入浓硫酸 无明显变化 常温下铁不与浓硫酸反应
B 将浓硫酸滴到白纸上 白纸变黑 浓硫酸强氧化性导致纸张中的纤维素炭化
C 二氧化硫通入溴水 溴水褪色 说明二氧化硫具有漂白性
D 湿润的PH试纸检验某气体 试纸变蓝 该气体是氨气
难度: 中等查看答案及解析
-
室温下,将0.1mol/L的H2 SO4溶液分别缓慢注入以下四种浓度均为0.1mol/L的溶液,各指标随加人H2 SO4溶液体积变化曲线图错误的是

难度: 中等查看答案及解析