-
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作
现象
A
加入NaOH溶液
有红褐色沉淀
B
加入Ba(NO3)2溶液
有白色沉淀
C
加入酸性KMnO4溶液
紫色褪去
D
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是
A. 加碘食盐的水溶液遇淀粉变蓝
B. 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
C. 我国预计2020年发射首颗火星探测器,太阳能电池帆板的材料是二氧化硅
D. 中国太钢集团造出的圆珠笔头,可完全代替进口笔尖,该笔头钢为合金,且具有良好的切削性
难度: 简单查看答案及解析
-
明代著名哲学家、科学家方以智在其《物理小识》卷七《金石类》中指出:有硇水者,剪银塊投之,则旋而为水。其中的“硇水”指
A. 醋酸 B. 盐酸 C. 硝酸 D. 硫酸
难度: 简单查看答案及解析
-
下列说法正确的是
A. 室温下,不能将浓硫酸盛放在铁桶中
B. 现在“点石成金”术石墨变成金刚石属于物理变化
C. 配制溶液定容时,仰视容量瓶刻度线,所配溶液浓度偏高
D. 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度
难度: 中等查看答案及解析
-
下列常见金属的冶炼原理中不合理的是
金属
冶炼原理
A
Fe
Fe2O3+2Al
2Fe+Al2O3
B
Hg
2HgO
2Hg+O2↑
C
Mg
H2+MgO
Mg+H2O
D
Cu
Cu2S+O2
2Cu+SO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关金属及其化合物的说法正确的是
A. 钠在空气中燃烧生成淡黄色的Na2O
B. 铝和氢氧化钠溶液反应生成Al(OH)3和H2O
C. 铁在高温下与水蒸气反应生成Fe3O4和H2
D. 铝、铁、铜在潮湿的空气中生锈均生成对应的氧化物
难度: 中等查看答案及解析
-
有NaCl、FeCl2 、FeCl3 、MgCl2 、CuCl2、AlCl3 、NH4Cl六种溶液, 只用一种试剂就可以把它们鉴别开来,该试剂是( )
A. 稀H2SO4 B. 氨水 C. NaOH溶液 D. 稀HNO3
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
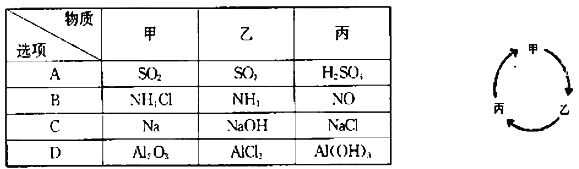
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
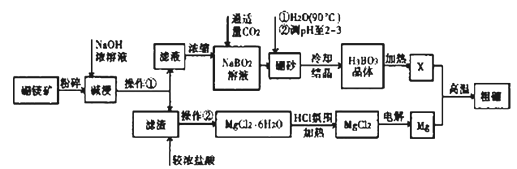
用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:

下列说法错误的是
A. 设计步骤①、②、③的主要目的是富集MgCl2
B. 脱水时在HCl气氛中进行可防止MgCl2发生水解
C. 电解得到的炽热镁粉不可在二氧化碳、氮气气氛中冷却
D. 上述工艺流程中涉及到的反应有置换反应、化合反应、复分解反应、分解反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法中正确的是
A. 由12C、16O、14N组成的44gCO2和44gN2O中含有的中子数均为22NA
B. 100g质量分数为46%的乙醇水溶液中含NA个氧原子
C. 0.1NA个HCl溶于100mL水中,所得溶液c(H+)=1.0mol/L
D. 22.4LN2和NH3混合气体中原子间共有3NA个共用电子对
难度: 中等查看答案及解析
-
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应.下列判断正确的是(不考虑NO2转化为N2O4)
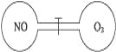
A.开始时左右两室分子数相同
B.反应前后NO室压强相同
C.最终容器内密度与原来相同
D.最终容器内无O2存在
难度: 中等查看答案及解析
-
下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是( )
选项
离子组
X试剂
离子方程式
A
K+、Na+、ClO-、SO42-
少量SO2
SO2+ClO-+H2O=SO42-+Cl-+2H+
B
NH4+、Fe3+、Br-、SO42-
过量H2S
2Fe3++H2S=2Fe2++S↓+2H+
C
NH4+、Na+、Fe3+、AlO2-
过量铜粉
2Fe3++Cu=2Fe2++Cu2+
D
K+、Na+、 HCO3-、AlO2-
少量HCl
H++AlO2-+H2O=Al(OH)3↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学中基本概念多,化学反应类型复杂,下列正确的叙述有
①CO2、NO2、P2O5均为酸性氧化物
②盐一定由金属元素和非金属元素组成
③FeCl2、FeCl3、Fe(OH)3均可由化合反应制得
④需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑤碘晶体分散到酒精中、氯化钠晶体分散到酒精中所形成的分散系分别为:溶液、胶体
⑥按照纯净物、混合物、电解质和非电解质顺序排列的是液氯、漂白粉、苛性钾,氯化银
⑦氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,蒸干、灼烧后都有氧化铁生成
⑧灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应A. 3个 B. 4个 C. 5个 D. 6个
难度: 中等查看答案及解析
-
己知溶质质量分数为96%的酒精溶液的物质的量浓度为16.6mol/L,则8.3 mol/L的酒精溶液的溶质质量分数为(已知酒精密度小于1 )
A. 小于48% B. 等干48% C. 大于48% D. 无法确定
难度: 中等查看答案及解析
-
为鉴别某固体物质的成分,某活动小组进行如下实验:
①取少量样品溶于水,加入硝酸酸化的氯化钡溶液,产生白色沉淀
②取①中上层清液,加入硝酸酸化的硝酸银溶液,产生白色沉淀
③取②中上层请液,加入KSCN溶液,溶液呈红色,加入氢氧化钠固体并加热,产生能使湿润的红色石蕊试纸变蓝的气体
下列说法正确的是
A. 原固体成分是(NH4)2Fe(SO4)2
B. 原固体成分是FeCl3和(NH4)2SO3的混合物
C. 原固体中只能确定一种离子肯定存在
D. 原固体中一定含有Cl-、NH4+,不能确定是否含有SO42-、Fe3+
难度: 中等查看答案及解析
-
某固体混合物可能由NaCl、NH4Cl、NaBr、Na2CO3、Na2SO3、Na2SO4中的一种或几种组成,准确称取4.7g 该固体混合物进行如下实验(所加试剂均足量,气体体积已折算成标准状况):

根据实验结果,下列有关说法正确的是
A. 原固体混合物中是否含有NaCl无法确定
B. 原固体混合物中必含有NH4Cl、Na2CO3、Na2SO4
C. “溶液2→白色沉淀3”的操作对混合物组成测定无作用
D. 若溶液l中只加BaCl2,则生成白色沉淀的质量必小于6.63g
难度: 困难查看答案及解析