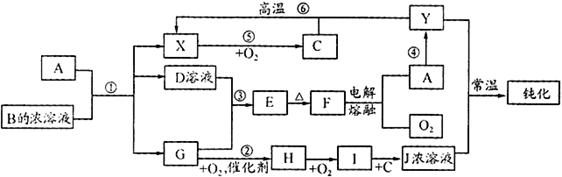
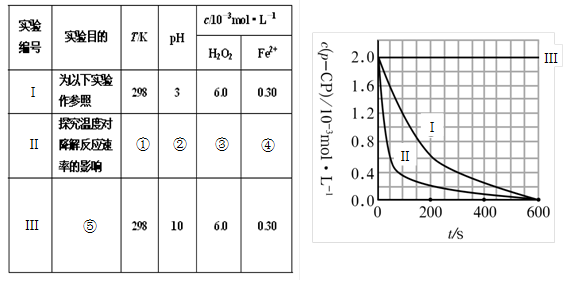
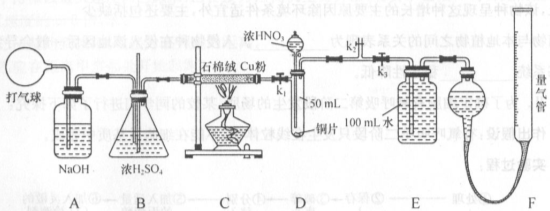
-
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2
B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
C.PCl3的水解产物是PH3和HClO D.A1(C2H5)3的水解产物是Al(OH)3与C2H6
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
B. 标准状况下,1.12 L的HCHO所含的原子数是0.2NA
C.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
D.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.常温下在酸度AG=lg〔c(H+)/c(OH-)〕=10的溶液中:Fe2+、K+、NO3-、SO42-
B.能溶解NH4HCO3固体产生气泡的溶液中:AlO2-、HCO3-、Ba2+、NO3-
C.使甲基橙变红的溶液中:NH4+ 、Na+、SO42-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、NH4+ 、SO42-、S2-
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A< D< B < C B.A的氢化物稳定性大于C的氢化物稳定性
C.A在自然界中只能以化合态形式存在 D.D的单质可使干燥的红色布条褪色
难度: 简单查看答案及解析
-
下列操作不会发生先沉淀后溶解现象的是
A.向AgNO3溶液中滴加氨水直至过量 B.向硫酸铝溶液中滴加氨水直至过量
C.向NaAlO2溶液中滴加稀盐酸直至过量 D.向澄清石灰水中通入CO2直至过量
难度: 简单查看答案及解析
-
下列现象或反应的原理解释正确的是
现象或反应
原理解释
A.
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔对熔化的铝有较强的吸附作用
B.
合成氨反应需在高温条件下进行
该反应为吸热反应
C.
镀层破损后,镀锡铁比镀锌铁易腐蚀
锡比锌活泼
D.
2CO=C+O2在任何条件下均不能自发进行
该反应△H>0,△S<0
难度: 简单查看答案及解析
-
以下实验方法能达到目的的是
A.皮肤上沾上少量苯酚可用稀NaOH溶液洗去
B.少量金属钠可保存在盛有乙醇的试剂瓶中
C.将海带灰用水浸泡,过滤后向滤液中通入氯气,用酒精可萃取出单质碘
D.仅通过物质间的相互反应即可鉴别出AlCl3、NaOH、HCl、NaCl四种溶液
难度: 简单查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp/25℃
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时的PH值范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
D.向该溶液中加少量铁粉即能观察到红色固体析出
难度: 简单查看答案及解析
-
氢元素与其他元素形成的二元化合物称为氢化物。下面关于氢化物的叙述正确( )
A.D2O与H2O是同位素 B.SiH4的稳定性>CH4的稳定性
C.氢氟酸的酸性>盐酸的酸性 D.NaH是离子化合物,其电子式为Na+[ xH]
难度: 中等查看答案及解析
-
将一块金属钠分别投入到下列物质中,有气体放出且溶液质量减轻的是 ( )
A.CuSO4溶液 B.稀盐酸 C.NaCI溶液 D.蒸馏水
难度: 中等查看答案及解析
-
下列各组物质中,不能按
(“一”表示一步完成)关系相互转化的是 ( )
a
b
c
A
H2O
O2
Fe(OH)3
B
CO2
C
CO
C
H2SO4
C
NO2
D
Si
SiO2
H2SiO3
难度: 中等查看答案及解析
-
含有NaOH 20.0 g的稀溶液与足量的稀盐酸反应,放出28.7 kJ的热量。能正确表示该反应中和热的热化学方程式是 ( )
A.NaOH +HCI NaCI+H2O △H=- 28.7 kj/mol
B.NaOH( aq)+HC1( aq) NaCl( aq)+H2O(1) △H=+57.4 kJ/mol
C. NaOH(1)+HCl(1) NaCl(l)+H2O(1) △H=- 57.4 kJ/mol
D.NaOH( aq)+HCl( aq) NaCI( aq)+H2O(1) △H=- 57.4 kJ/mol
难度: 中等查看答案及解析
-
下列各组离子,在pH =l的溶液中能够大量共存的是 ( )
A.Na+、NH4+、S2—、Cl— B.Al3+、Mg2+、SO42-、Cl—
c.Ba2+、Ca2+、SiO32—、NO—3 D.K+、Na+、SO42—、SO32—'
难度: 中等查看答案及解析
-
下列物质中,既有共价键又有分子间作用力的是 ( )
A.氦 B.氨 C.铜 D.二氧化硅
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al + 2OH-= 2AlO
+ H2↑
B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
C.氯气通入NaOH稀溶液中:Cl2 + 2OH-= Cl-+ ClO-+ H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H+ + SO
+ Ba2+ + OH-= BaSO4↓+ H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.若发生A2+ 2D-=2A-+ D2反应,则氧化性D2>A2
B.若X原子的质子数是a,中子数是b,则该核素可表示为
X
C.若相同温度和浓度的两种钠盐溶液的碱性NaA<NaB,则酸性HA>HB
D.若主族元素的简单离子R 2- 和M+的电子层结构相同,则原子序数R>M
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是 ( )
A.标准状况下,2.24 L O3所含有的电子数为2.4NA
B.含有NA个Na+的Na2O溶解于1L蒸馏水中,所得溶液中c(Na+)=l mol/L
C.42 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.25℃,l L纯水中含有的H+数为l×10-7NA
难度: 中等查看答案及解析
-
纳米泡沫碳是一种固体单质碳,外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是 ( )
A.同一种物质 B.同分异构体 C.同系物 D.同素异形体
难度: 中等查看答案及解析
-
下列叙述不正确的是 ( )
A.含有金属元素的晶体不一定是离子晶体 B.原子晶体中只存在共价键
C.HF、HC1、HBr、HI四种物质的沸点依次升高
D.金属晶体之所以能导电是因为其中含有自由移动的电子
难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的 ( )
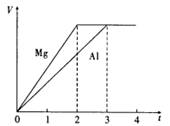
A.摩尔质量之比为2:3 B.物质的量之比为3:2
C.质量之比为3:2 D.反应速率之比为2:3
难度: 中等查看答案及解析
-
将4molA和2molB放入2L密闭容器中发生反应
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
难度: 中等查看答案及解析
-
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性义可表现还原性,有关该物质的说法正确的是 ( )
A.在CsICl2溶液中通入SO2气体,有硫酸生成 B.Cs显+1价,Cl显+l价,l显-l价
C.在CslCl2溶液中通入C12,有单质碘生成 D.Cs显+3价,I、Cl均显一l价
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中,发生反应
(注:x为P物质前的系数)①将3mol M和2 mol N在一定条件下反应,达平衡时P的体积分数为a;②若起始时M、N、P投入的物质的量分别为n(M)、n(N)、n(P),平衡时P的体积分数也为a。则下列说法正确的是 ( )
A.若①达平衡时,再向容器中各增加l mol M、N、P,则N的转化率一定增大
B.若向①平衡中再加入3mol M和2 mol N,P的体积分数若大于a,可判定x>4
C.若x=2,则②体系起始物质的量应当满足3 n(N)=n(M)
D.若②体系起始物质的量满足3 n(P)+8 n(M)=12 n(N),可判定x=4
难度: 中等查看答案及解析
-
下列实验装置、试剂选用或操作正确的是

A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
难度: 中等查看答案及解析
-
研究性学习小组进行了一系列化学实验后,发现高锰酸钾及其分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且含锰化合物的还原产物都是MnCl2。他们将6.32g KMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0. 112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
A.0. 448L B.2.240L C.2.016L D.无法确定
难度: 中等查看答案及解析
-
某单质跟足量浓硝酸反应时(还原产物只有NO2)每有0.5mol的单质反应就消耗2molHNO3,则单质中的元素氧化后的化合价可能是下列中的:
①+1 ②+2 ③+3 ④+4
A. ② B.④ C.②④ D.①③
难度: 中等查看答案及解析