-
硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
| 温度( ) ) | 20 | 40 | 60 | 80 | 100 |
| 石膏(g) | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾(g) | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是__________________。
(2)写出浸出过程中生成铜离子的离子方程式________________________________________。
(3)操作I包括蒸发浓缩、__________等操作,温度应该控制在_____ 左右;
左右;
(4)从溶液中分离出硫酸铜晶体操作Ⅱ应采用_______结晶;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_______________________________________;干燥时采用晾干,不用加热烘干的原因是_________________________。
-
氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时,存在以下反应:
①N2(g)+O2(g)  2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
②2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
③4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g) 2NH3(g) △H=____________kJ·mol-1。
2NH3(g) △H=____________kJ·mol-1。
(2)在恒温恒容容积为1 L的密闭容器中进行合成氨的反应,起始加入N2:1.0 mol、H2:3.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________。
②若其它条件不变增大压强,则合成氨反应的化学平衡常数_____________(填“变大”、“变小”或“不变”);
③经过2min达到化学平衡状态时测得H2的浓度为1.8mol/L,则平均化学反应速率v(NH3)_____________,氢气的转化率为________________。
④下图表示合成氨反应中H2 (g)的平衡转化率随温度的变化关系,判断P1_____P2(填“>”“ <”或“ = ”),并简述理由:__________________。

-
控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表:
| 离子 | SO42− | Cl− |
| c/(mol·L−1) | 5×10−3 | 1×10−2 |
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________。阴极的电极反应为:_________________________________。总反应的化学方程式为:___________________________。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________L。
-
X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________(用化学式表示),原因是__________________________。
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________,该物质硬度大,推测该物质为_____________晶体。其中Y元素的杂化方式是_____________。
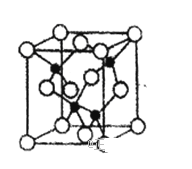
-
光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):

已知Ⅰ. (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ. 
Ⅲ. (R,R′为烃基)
(R,R′为烃基)
(1)写出A的结构简式_____________、C的结构简式:_____________。
(2)由B生成C的反应试剂还可以选用_____________________。
(3)由B到C的反应类型为_____________。由F到G的反应类型为_____________。
(4)D和G反应生成光刻胶的化学方程式为_________________________________________________。
(5)写出由A生成B的化学反应方程式:___________________________________________________。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②苯环上的一氯取代产物只有两种。写出该同分异构体的结构简式:_____________。





 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)