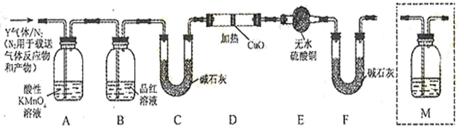
-
下列离子方程式正确的是
A.钠与硫酸铜溶液反应:Cu2++2Na==2Na++Cu
B.铁屑溶于过量稀硝酸:3Fe+8H++2NO3—==3Fe2++2NO↑+4H2O
C.石灰石溶于醋酸:CaCO3+2CH3COOH==2CH3COO—+Ca2++CO2↑+H2O
D.FeI2溶液中通入少量氯气:2Fe2++Cl2==Fe3++2Cl—
难度: 中等查看答案及解析
-
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如右图的转化关系(部分产物及反应条件已略去):
下列判断正确的是
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
难度: 中等查看答案及解析
-
在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50mL0.5mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
A、N2O B、NO C、N2O3 D、NO2
难度: 中等查看答案及解析
-
下列实验合理的是
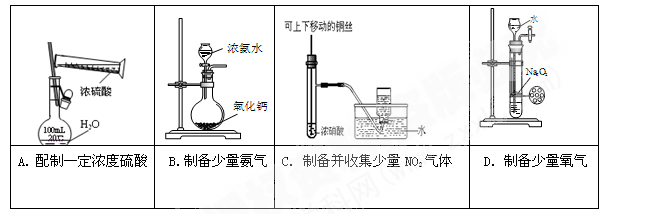
难度: 中等查看答案及解析
-
某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl—的物质的量为:
A.mol B.mol C.mol D.mol
难度: 中等查看答案及解析
-
如下图,在25℃,101.3KPa下,将10mLO2全部压入左端盛有20mLNO的注射器中充分反应。
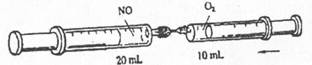
以下对压入O2后左端注射器中的气体描述错误的是
A.气体变为红棕色
B.气体体积仍为20mL
C.气体变为混合物
D.气体中氮原子与氧原子物质的量之比等于l:2
难度: 中等查看答案及解析
-
科学家正拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。关于这种分子的下列说法,正确的是
A、它是两种单质组成的混合物 B、它是一种硅酸盐
C、它是一种新型化合物 D、它是一种高聚物
难度: 中等查看答案及解析
-
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于 Y的说法不正确的是
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数为39 D.Y和Y是两种不同的核素
难度: 中等查看答案及解析
-
下列说法正确的是:
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.①④⑤ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
是一种常用的预防“禽流感”的消毒剂,可通过以下反应制得(未配平):
下列说法正确的是
A.
做氧化剂 B.
是氧化产物
C.
被氧化 D.每消耗lmol
就有2mol电子转移
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列叙述中正确的是
A.3.4gNH3中含有电子数为0.2NA
B.标准状况下,22.4 L Cl2参加所有化学反应转移的电子数一定都是2NA
C.标准状况下,0.5NA个SO3分子所占的体积约为11.2 L
D.在18
中含有
个氧原子
难度: 中等查看答案及解析
-
下列无色溶液中的离子能大量共存的是
A.K+、Na+、MnO4-、SO42-
B.H+、K+、NO3-、SO32-
C.Na+、Ba2+、Cl-、Br-
D.Fe3+、NH4+、SCN-、HCO3-
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如右图所示。
X
Y
Z
W
下列说法中,正确的是
A.Y的原子半径在同周期主族元素中最大
B.W的最高价氧化物对应的水化物是强酸
C.X原子最外层电子数为8
D.Z的气态氢化物的稳定性在同主族元素中最强
难度: 中等查看答案及解析
-
工业上冶炼金属,常用的方法有四种:Ⅰ、热分解法,Ⅱ、热还原法,Ⅲ、电解法,Ⅳ、湿法冶金。下表中金属与常用冶炼方法相符的是:

难度: 中等查看答案及解析
-
下列关于离子检验的说法中,正确的是
A.向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32-
B.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl-
C.向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2 是酸性氧化物,能溶于水生成H2SiO3
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水有酸性和强氧化性,故滴入少量的紫色石蕊的现象是先变红,后褪色
难度: 中等查看答案及解析
-
下列判断中一定正确的是
A.若A2 + 2D- = 2A-+D2,则还原性:D-﹥A-
B.若R2-和M+的电子层结构相同,则原子序数:R>M
C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
难度: 中等查看答案及解析
-
A、B、C都是短周期元素,原子序数依次增大。B是地壳中含量最多的元素;化合物AxBy有多种形式,有的可以导致酸雨;化合物CmBn也有不同形式,其中m、n可以是2:1或1:1。下列判断正确的是:
A、原子半径由大到小的顺序是:C>B>A
B、AxBy中A的化合价不可能为+1价
C、C与B形成的化合物溶于水都能得到单质B
D、A、B两元素的气态氢化物可以相互反应
难度: 中等查看答案及解析
-
下列类比关系正确的是
A.AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O也生成AlO2-
B.Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
难度: 中等查看答案及解析