-
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是( )
①用50 mL量筒量取5.2 mL稀硫酸
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量11.7 g氯化钠晶体
④用碱式滴定管量取23.10 mL溴水
⑤用瓷坩埚灼烧各种钠化合物
⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④ B.②③④⑥ C
.③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是( )
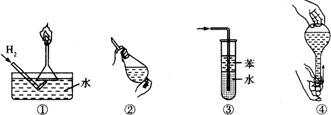
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开
活塞使分液漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用广泛pH试纸测得饱和氯水的pH约为2.2
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小
C.用待测液润洗锥形瓶后才能进行滴定操怍
D.中和反应热测定实验中,要将盐酸逐滴加入烧碱溶液
难度: 简单查看答案及解析
-
下图表示某反应的
能量变化,对于该图的理解,你认为一定正确的是( )

A.曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化
B.曲线Ⅱ可表示反应2KClO3
2KCl+3O2↑的能量变化
C.该反应不需要加热就能发生
D.该反应的ΔH=E2-E1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.如果不慎将酸粘到皮肤或衣物上,立即用大量的水冲洗,再用饱和NaHCO3溶液洗,最后再用水冲洗。
B.海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1﹣2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子
C.检验Fe(NO3)2晶体是否已氧化变质的方法是:将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
D.用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,并用水洗涤量筒,洗涤液一并倒入烧杯中
难度: 中等查看答案及解析
-
下列图中的实验方案,能达到实验目的的是( )

难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无
“0”刻度,滴定管有“0”刻度
B.如果酒精刚刚着火,可直接用湿抹布盖灭;若酒精燃烧有一定时间,则用CO2灭火器灭火
C.室温下,浓度均为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响
D.往K2CrO4溶液中滴加稀硫酸,溶液由黄色变为橙色
难度: 中等查看答案及解析
-
下列有关钢铁腐蚀和防护的说法不正确的是( )
A.自行车的钢圈上镀一层铬,防止生锈
B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连
C.钢铁发生吸氧腐蚀的正极反应:2H2O+O2 - 4e-===4OH-
D.钢铁发生析氢腐蚀的负极反应:Fe-2e-===Fe2+
难度: 中等查看答案及解析
-
瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如图所示,下列有关说法正确的是( )
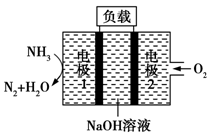
A.电极2发生氧化反应
B.电池工作时,Na+向负极移动
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为2NH3+6OH--6e-===N2↑+6H2O
难度: 中等查看答案及解析
-
已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,质量为m2。下列说法正确的是( )
A.设锌镀层厚度为h,锌的密度为ρ,则h=(m1-m2)/( ρS)
B.锌电极的电极反应式为 2H2O + 2e- =
H2 + 2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁皮,冲洗后用酒精灯加热烘干,铁片可能部分被氧化导致实验结果偏低
难度: 困难查看答案及解析
-
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是( )

A.Li发生氧化反应,a极为阴极
B.电子由a极流出通过电流表流入b极,然后再由b极经内电 路回到a极
C.可以用水代替SO(CH3)2做溶剂
D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
难度: 中等查看答案及解析
-
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
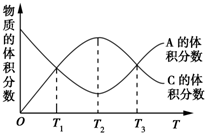
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
难度: 中等查看答案及解析
-
往2 L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。下列说法正确的是( )
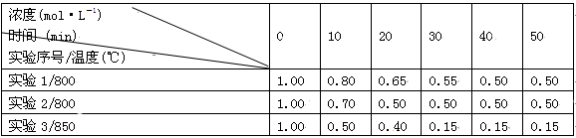
A.实验2比实验1的反应容器内压强小
B.实验2比实验1使用了效率更高的催化剂
C.实验
1比实验3的平衡常数大
D.由实验2和实验3可判断该反应是放热反应
难度: 简单查看答案及解析
-
下列关于化学实验的说法正确的是( )
A.分离物质的量之比为1:6的氯化钠和硝酸钾混合物时,可先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得到硝酸钾晶体;将母液加热蒸干得到氯化钠晶体。
B.在“反应热的测量和计算”实验时须先将用于实验的等体积等物质的量的稀NaOH和稀HCl溶液置于相同温度(一般为25℃)下保温一段时间后再混合
C.在电化学实验中常使用碳电极,实验室一般采用多孔碳棒作为碳电极。有些电化学反应中的气体产物可以自由填充在多孔碳棒的疏松空隙中,从而增大气体的吸收量。
D.为了降低HNO3与Cu反应制备NO2的速率,可以用稀硝酸代替浓硝酸
难度: 简单查看答案及解析
-
在容积不变的密闭容器中进行反应: 2SO2(g)+O2(g)
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应
的影响,其中分析正确的是( )
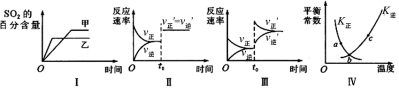
A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
难度: 困难查看答案及解析
-
将4molA气体和2molB气体在2L的容器中混合,在一定条件下发生如下反应:2A(g) +B(g)
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A的浓度变化表示的反应速率为0.3mol·L-1·s-1,②用物质B的浓度变化表示的反应速率为0.6 mol·L-1·s-1,③平衡时物质A的转化率为70%,④平衡时物质B的浓度为0.7mol·L-1,其中正确的是()
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是
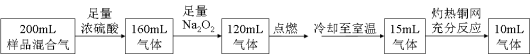
A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
难度: 困难查看答案及解析
-
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )

A.电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应式为:2H++NO3-+e-= NO2↑+H2O
B.已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A
C.若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连
D.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏低
难度: 简单查看答案及解析