-
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松果不及也,此物必大行于世”的描述, 关于上文的下列说法中正确的是 ( )
A.“洧水”的主要成分是油脂 B.“洧水”的主要成分是煤油
C.“洧水”的主要成分是石油 D.其烟的主要成分是石墨
难度: 简单查看答案及解析
-
NA表示阿伏加徳罗常数的值,下列有关叙述正确的个数为( )
①1 mol苯乙烯中含有的碳碳双键数为4NA
②4.2 g乙烯和丙烯混合气中含有的极性链数目为0.6NA
③标况下,3.36 LSO3含有的电子数为1.5NA
④常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下,4.6g NO2和N2O4混合气体屮所含原子总数为0.3NA
⑥在KClO3 + 6HCl(浓)=KCl + 3Cl2+3H2O反应中,每生成1 mol Cl2,转移的电子总数为2NA
⑦1 mol铁粉在1 mol氧气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
A.3个 B.4个 C.5个 D.6个
难度: 简单查看答案及解析
-
下列各组离子或分子能大量共存,当加人相应试剂后,发生反应的离子方程式书写正确的是( )
选项
离子组
加人试剂
加人试剂后发生反应的离子方程式
A.
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++ SO42- + 2OH- = BaSO4↓+ 2NH3 • H2O
B.
Na+、OH-、Cl-
少量Mg(HCO3)2溶液
Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32-
C.
K+、NH3·H2O、CO32-
通人少量CO2
2OH-+CO2=CO32-+H2O
D.
Fe2+、NO3-、HSO3-
NaHSO4溶液
HSO3- +H+ = SO2↑+H2O
难度: 简单查看答案及解析
-
下列有关实验的说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.在4 mL0.1 mol/L的K2Cr2O7溶液中滴加数滴1 mol/L的NaOH溶液,溶液颜色从橙色变成黄色
C.探究化学反应的限度:取5 mL 0.1 mol/LKI溶液,滴加0.1 mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
D.将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶、过滤即可得到大量硝酸钾晶体
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2=H2O2+S,已知甲池中发生的反应为
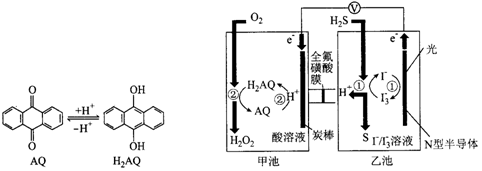
下列说法正确的是( )
A.该装置中电能转化为光能
B.H+从甲池移向乙池
C.甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
D.乙池溶液屮发生的反应为H2S+I3-=3I-+S+2H+
难度: 困难查看答案及解析
-
25 ℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+) = 0.1 mol/L的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述 一定正确的是( )
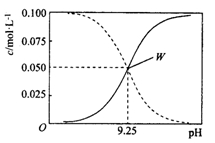
A.W点表示的溶液中c(NH4+)+c(H+)=c(OH-)
B.pH= 10.5的溶液中:c(Cl-)+c(OH-)+c(NH3 • H2O)<0.1 mol/L
C.pH= 9.5的溶液中:c(NH3 • H2O)>c(NH4+)>c(OH-)>c(H+)
D.向W点所表示的1L溶液中加人0.05 mol NaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+ )>c(OH- )>c(NH4+)>c(H+)
难度: 困难查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种短周期元素且B、C相邻,A元索可以与B、C、E元素分别形成甲、乙、丙三种物质且甲、乙均为10电子化合物,丙为18电子化合物。D元索的最外层电子数与核外电子层数相等。已知:甲+E2=丙+ Br2,甲+丙=丁,下列说法中正确的是( )
A. 离子半径:D>C>B
B. A与B两种元素共同形成的10电子粒子有3种
C. D元素在周期表中的位置是第二周期第ⅡA族
D. 丁物质均由非金属元索构成,只含共价键
难度: 中等查看答案及解析
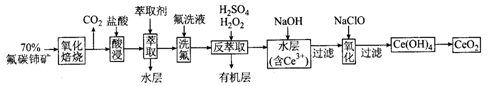
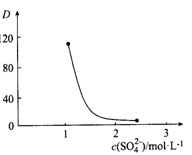
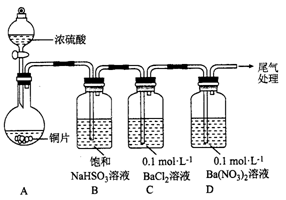
 ,可由化合物甲生成。其转化关系及相应反应如下:
,可由化合物甲生成。其转化关系及相应反应如下:

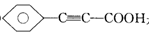 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成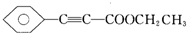 的路线(其他试剂任选):
的路线(其他试剂任选):