-
能源紧张、资源短缺、环境恶化是当今世界面临的三大问题,下列说法错误的是
A.电池外壳的金属材料回收再利用
B.将地沟油回收再加工为食用油,提高资源的利用率
C.目前我国使用的主要能源是化石燃料,化石燃料属于不可再生能源
D.能源的开发和利用情况,可以衡量一个国家或地区的经济发展和科学技术水平
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以测定的反应焓变
D.同温同压下,
在光照和点燃条件的
不同
难度: 中等查看答案及解析
-
下列实验操作正确的是
A.用pH试纸测得某新制氯水的pH值为3.5
B.电解法精炼铜,将粗铜接电源的正极
C.将氯化铁晶体溶于蒸馏水中,配制氯化铁溶液
D.将氯化铁溶液加热蒸干,再灼烧,就得到氯化铁晶体
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)=
mol·L-1
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
难度: 困难查看答案及解析
-
《化学反应原理》模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;⑥化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②④⑤⑥ B.①④⑤⑥ C.②③⑤⑥ D.①②④⑤
难度: 中等查看答案及解析
-
一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化 ④单位时间内生成n mol Z,同时生成n mol X
A.①② B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
对于相同体积的K2CO3溶液(浓度为c1) 和 (NH4)2CO3溶液(浓度为c2),若其中CO的物质的量浓度相同,则c1和c2的关系是
A.c1=c2 B.c1<c2 C.c1≥c2 D.c1>c2
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.铜锌原电池工作时,锌电极发生氧化反应
D.锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是
A.将CH3COONa·3H2O晶体溶于水,温度降低
B.醋酸钠溶液的pH大于7
C.醋酸钠溶液中滴入酚酞显红色,加热后,颜色变深
D.醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、H+、Fe2+、NO3-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.含0.1mol·L-1 HCO3-的溶液中:Al3+、Ca2+、NO3-、SO42-
D.含0.1 mol·L-1 SCN-的溶液中:Fe3+、NH4+、NO3-、Cu2+
难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体生成1mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4bkJ· mol-1
B.C2H2(g)+
O2(g)=2CO2(g)+H2O(l) ΔH=-2bkJ· mol-1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O2(l) ΔH=-2bkJ· mol-1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O2(l) ΔH=-bkJ· mol-1
难度: 中等查看答案及解析
-
如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间。

下列有关描述错误的是
A.两块生铁片均发生电化学腐蚀
B.墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式为Fe - 2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
用于解释下列现象的化学用语表述正确的是
A.硫化钠溶液呈碱性:S2-+ 2H2O
H2S+2OH-
B.亚硫酸溶液呈酸性:H2SO3=2H++SO32-
C.FeCl3溶液呈酸性:Fe3++3H2O
Fe(OH)3+3H+
D.氯化铝溶液跟过量的氨水反应:Al3+ + 4OH-= [Al(OH)4]-
难度: 中等查看答案及解析
-
下列关于pH=3的盐酸和醋酸溶液的说法正确的是
A.两种溶液中由水电离出来的c(H+)不相同
B.中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,则a<b
C.加入足量的铁粉,放出H2的体积相同
D.分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m=n
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取、制备Cu2O的电解池示意图如下图所示,电解总反应:2Cu+H2O===Cu2O+H2↑。下列说法正确的是
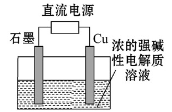
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1mol Cu2O生成
难度: 中等查看答案及解析
-
汽车尾气净化中的一个反应:NO(g) + CO(g)
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是

难度: 中等查看答案及解析

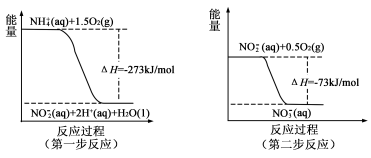
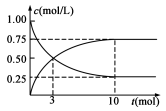
 请回答:
请回答: