-
“浙中生态廊道”不仅是深化金华“五水共治”的新战场,也是一条集生态保护、休闲观光、文化体验于一体的“山水林田湖”生命共同体。下列关于“浙中生态廊道”的叙述不合理的是( )

A.有利于治理水污染 B.可以杜绝酸雨的形成
C.有利于治理雾霾污染 D.有利于保护水域生态系统
难度: 中等查看答案及解析
-
将宏观、微观及化学符号联系在一起是化学学科的特点。在一定条件下,A和B能发生化学反应生成C和D。其微观示意图如图所示,下列相关叙述正确的是( )
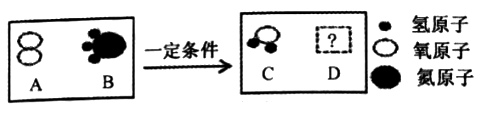
A.从宏观角度看,物质C由两种元素组成,属于混合物
B.从微观角度看,该化学变化中发生根本改变和微粒是原子
C.若D为空气中体积分数最大的气体,则D的微观符号可表示为N2
D.该反应属于基本反应类型中的转换反应,反应前后各元素化合价不变
难度: 中等查看答案及解析
-
归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )
A.有机物是一类含碳化合物,所以CH4、CO2都是有机物
B.硫酸、盐酸电离时都能产生H+,所以电离能产生H+的化合物是酸
C.金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气
D.氧化物是由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物
难度: 中等查看答案及解析
-
利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有( )
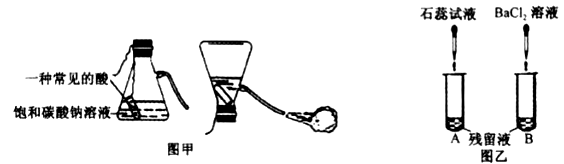
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
难度: 中等查看答案及解析