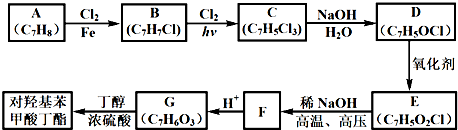
-
据报道,科学家已成功合成了少量O4(其结构式是
),有关O4的说法正确的是( )
A.O4的摩尔质量是64g
B.O4和O2互为同位素
C.相同质量的O4与O3所含原子个数比为4:3
D.O4与O3、O2都是氧元素的同素异形体
难度: 简单查看答案及解析
-
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧,其主要化学成分的结构简式为:
 ,下列有关该有机物的叙述正确的是( )
,下列有关该有机物的叙述正确的是( )A.分子式为C8H10NO2
B.该有机物属于α-氨基酸
C.该有机物与FeCl3溶液发生显色反应
D.该有机物属于α-氨基酸的同分异构体有3种
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol-1,则H2O(g)
H2O(l)的△H=40.69kJ•mol-1
B.常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小
C.已知:
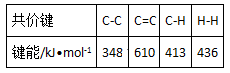 则反应
则反应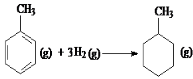 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+ 14×413)]kJ•mol-1 =-384kJ•mol-1
的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+ 14×413)]kJ•mol-1 =-384kJ•mol-1D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6
难度: 困难查看答案及解析
-
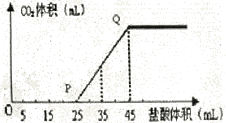
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )

A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
难度: 困难查看答案及解析
-
下列叙述中,正确的是( )
A.依据铝热反应原理,能发生反应2Al+3MgO
3Mg+Al2O3
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CH3COO-、Cl-一定能够大量共存
C.铁片放入过量的稀硝酸中:3Fe+8H++2 NO3-═3Fe2++2NO↑+4H2O
D.氯化铝溶液中加入过量氨水反应实质是Al3++3NH3•H2O═Al(OH)3↓+3 NH4+
难度: 中等查看答案及解析
-
如图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是( )
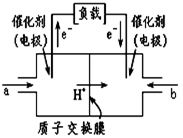
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+2H2O+4e- =4OH-
C.负极反应式为:CH3OH+H2O-6e- =CO2+6H+
D.该电池提供1mole-,消耗氧气0.25mol
难度: 中等查看答案及解析
-
已知0.1mol/L的二元酸H2B溶液的pH=4.0则下列说法中正确的是( )
A.在Na2B、NaHB两溶液中,离子种类不相同
B.二元酸H2B为强酸
C.在NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-)
D.在Na2B溶液中一定有:c(Na+)>c(B2-)>c(H+)>c(OH-)
难度: 中等查看答案及解析