-
化学与生活息息相关,下列说法错误的是
A.乙烯可作为水果的催熟剂
B.地沟油经过处理,可用来制造肥皂
C.漂白粉长期暴露在空气中会变质失效
D.丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体
难度: 简单查看答案及解析
-
X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和,W与Y属于同一主族。下列叙述正确的是
A.Y、Z、R元素简单离子的半径依次增大
B.含有Y、Z、R三种元素的化合物最多只有2种
C.元素W和R最高价氧化物对应水化物的酸性后者强
D.Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8g CH4含有4NA个氢原子
B.1mol Cu与足量FeCl3溶液反应,转移2NA个电子
C.1L0.1 mol·L-1(NH4)2SO4溶液中含有0.2NA个NH4+
D.10 L pH=l的硫酸溶液中含有的H+离子数为2NA
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是
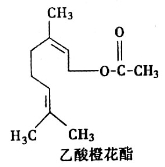
A.分子式为C12H20O2
B.能使酸性KMnO4溶液褪色
C.能发生加成反应,但不能发生取代反应
D.1mol该有机物水解时只能消耗l mol NaOH
难度: 中等查看答案及解析
-
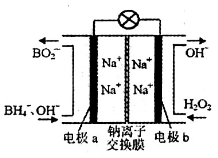
向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断错误的是
A.整个过程共发生2个氧化还原反应
B.所有阴离子的浓度都发生了变化
C.溶液的颜色发生了变化
D.反应过程中既有气体产生,也有沉淀产生
难度: 中等查看答案及解析
-
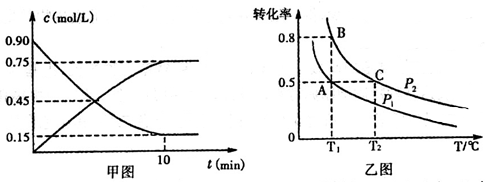
常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
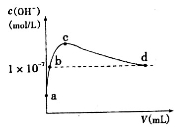
A.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
难度: 困难查看答案及解析