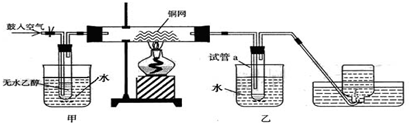
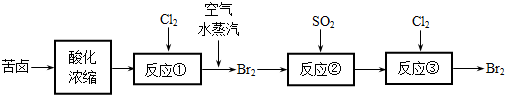
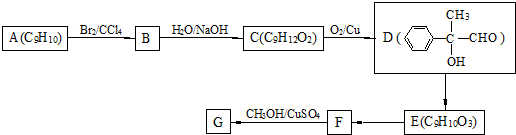
-
只用水就能鉴别的物质组是( )
A.苯、乙酸、CCl4
B.乙醇、乙醛、乙酸
C.乙二醇、乙醛、硝基苯
D.乙醇、甘油、苯酚难度: 中等查看答案及解析
-
下列关于化学反应的自发性叙述中正确的是( )
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的难度: 中等查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
A.由水电离的C(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
D.等体积的①、②、④溶液分别与铝粉反应,生成H2的量:②最大难度: 中等查看答案及解析
-
2007年1月1日,我国科学家在全球率先成功发现了有效治疗Ⅱ型糖尿病的神奇分子--非肽类分子激动剂(代号为Boc5,化学式为C54H52N4O16S2),它的神奇之处在于能模拟人体内的某些大分子,促进人体的胰岛素分泌,发挥对血糖的调节作用,这一发现将为千百万Ⅱ型糖尿病患者解除病痛.则下列说法正确的是( )
A.Boc5中一定不含
B.葡萄糖、麦芽糖、蔗糖均能与新制氢氧化铜反应生成Cu2O
C.Boc5是高分子化合物
D.糖类的通式均满足 (CH2O)n难度: 中等查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.已知有关物质的颜色和溶度积如下:
下列叙述不正确的是( )物质 AgCl AgI Ag2S 颜色 白 黄 黑 KSP(25℃) 1.8×10-10 1.5×10-16 1.8×10-50
A.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.溶度积小的沉淀可以转化为溶度积更小的沉淀
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶度积相同难度: 中等查看答案及解析
-
化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是( )
A.鉴别溶液中是否含有Br-时,所加的AgNO3溶液用硝酸酸化
B.检验C2H5Cl中含Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸酸化
D.为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化难度: 中等查看答案及解析
-
通式为C6H5-R(R为-H、-C2H5、-OH、-NO2和-COOH)的5种有机物,取等质量的5种物质分别混合于乙醚中,然后用氢氧化钠溶液来进行萃取,振荡一段时间,静置后能够进入水层的物质有( )
A.1 种
B.2 种
C.3 种
D.4 种难度: 中等查看答案及解析
-
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
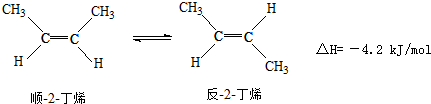
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯氢化的热化学方程式为:+H2(g)→CH3CH2CH2CH3(g),△H=-118.9 kJ•mol-1
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验,能达到实验目的是( )
A.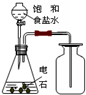
制取并收集乙炔
B.
比较NaHCO3、Na2CO3对热稳定性
C.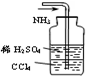
吸收多余的NH3
D.
实验室中制取少量乙酸乙酯难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH)
D.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6 mol•L-1难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O
C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32-
D.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O难度: 中等查看答案及解析
-
设N为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g氧气和32 g臭氧所含有的氧原子数都为2 N
B.标准状况下,22.4 L辛烷完全燃烧,生成CO2的分子数为8 N
C.1L 0.l mol•L-1的醋酸溶液中,离子和分子的总数为0.1 N
D.0.1 mol铁在纯氧中充分燃烧,失去的电子数为0.3 N难度: 中等查看答案及解析
-
搞好兴奋剂管理是确保2008年奥运会成功举办的主要措施之一.国家体育总局转发了世界兴奋剂机构《2008年禁用清单》,违禁药物有216种,甲异炔诺酮(tibolone)是其中之一,它的结构式如右图,下列有关说法不正确的是( )
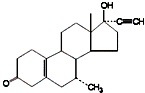
A.甲异炔诺酮中含有的官能团有羟基、碳碳叁键、碳碳双键及羰基
B.甲异炔诺酮分子中含有4个手性碳原子
C.1mol甲异炔诺酮在浓硫酸作用下脱去1分子水,所得产物有两种
D.1mol甲异炔诺酮与足量的氢气催化加成,最多消耗4molH2难度: 中等查看答案及解析
-
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌xC(g),△H<0.平衡时M中A、B、C的物质的量之比为1:3:4.下列判断正确的是( )
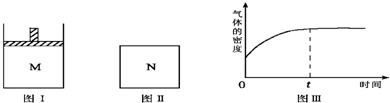
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率难度: 中等查看答案及解析