-
在 298 K、1.01×105 Pa 下,将 22 g CO2通入 750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出a kJ 的热量。已知在该条件下,1 mol CO2通入 1 L 2 mol·L-1 NaOH 溶液中充分反应放出b kJ 的热量。则 CO2与 NaOH 溶液反应生成 NaHCO3的热化学方程式为
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2b-a)kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2a-b)kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4a-b)kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8a-2b)kJ·mol-1
难度: 困难查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键形成的变化是( )
A. 酒精溶解于水
B. 白磷熔化
C. 氯化钠受热熔化
D. 碳酸氢铵受热产生刺激性气味气体
难度: 中等查看答案及解析
-
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A. 制催化剂的材料 B. 耐高温、耐腐蚀的合金材料
C. 制农药的材料 D. 半导体材料
难度: 中等查看答案及解析
-
元素性质呈现周期性变化的根本原因是
A. 元素的原子量逐渐增大 B. 核外电子排布呈周期性变化
C. 核电荷数逐渐增大 D. 元素化合价呈周期性变化
难度: 简单查看答案及解析
-
科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列说法正确的是( )
A. 第七周期有50种元素 B. 该原子的质量数为184
C. 该元素的相对原子质量为298g D. 该原子核外有114个电子
难度: 简单查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
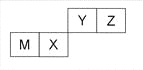
A. 原子半径Z<M
B. Y的最离价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期、第ⅥA族
难度: 困难查看答案及解析
-
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
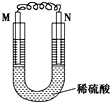
A. 导线中有电流通过,电流方向是由N到M
B. N上有气体放出
C. M为正极,N为负极
D. M极上发生氧化反应
难度: 简单查看答案及解析
-
下列化学用语表达正确的是( )
A. MgCl2的形成过程可表示为
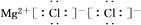
B. H2O分子的结构式可表示为H—O—H
C. 质子数为92、中子数为146的U原子:
D. Cl原子的结构示意图:
难度: 简单查看答案及解析
-
(核磁共振)可用于含碳化合物的结构分析
N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关。
叙述正确的是
A.
与砖
N具有相同的中子数 B.
C与
是同一种物质
C.
N与
N互为同位素 D.
N的核外电子数与中子数相同
难度: 中等查看答案及解析
-
如图所示,有关化学反应和能量变化的说法正确的是
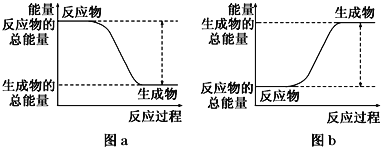
A. 图a表示的是吸热反应的能量变化
B. 图b中反应物比生成物稳定
C. 图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D. 图a不需要加热就一定能发生,图b一定需要加热才能发生
难度: 中等查看答案及解析
-
已知:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,有关物质的相关数据如下表:

则表中a为( )
A. 404 B. 260 C. 230 D. 200
难度: 简单查看答案及解析
-
下列物质中,既含有离子键,又含有非极性键的是( )
A. NaOH B. Na2O2 C. MgCl2 D. H2O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. Li是最活泼金属,F是最活泼非金属
B. Mg(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,共16个纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W。下列说法正确的是( )
A. 四种元素在自然界均不能以游离态存在
B. 氢化物的稳定性:X<Y
C. 元素X、Y、W的最高化合价均与其族序数相等
D. 离子半径:W>Z>Y
难度: 简单查看答案及解析
-
如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )

M
N
P
A
Zn
Cu
稀硫酸溶液
B
Cu
Fe
稀盐酸
C
Ag
Zn
硝酸银溶液
D
Zn
Fe
硫酸亚铁溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn-2e-===Zn2+,2NH
+2e-===2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论正确的是( )
①锌为正极,石墨为负极
②锌为负极,石墨为正极
③工作时,电子由石墨极经过外电路流向锌极
④长时间连续使用时,内装糊状物可能流出腐蚀用电器
A. ①③ B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为FeSO4溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
下列各组中化合物的性质比较,不正确的是( )
A. 酸性:HClO4>HBrO4>HIO4 B. 碱性:NaOH>Mg(OH)2>Al(OH)3
C. 稳定性:PH3>H2S> HCl D. 非金属性:F>O>S
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是

A. 194 B. 391 C. 516 D. 658
难度: 困难查看答案及解析
-
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物的水化物可以相互反应
D. 庚的最高价氧化物的水化物酸性最强
难度: 简单查看答案及解析
-
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A. A>B>C>D B. D>A>B>C C. C>A>B>D D. B>C>A>D
难度: 中等查看答案及解析
-
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是
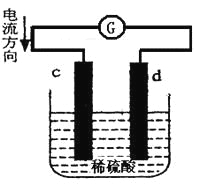
A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
难度: 简单查看答案及解析
-
已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l) ΔH=+Q1kJ·mol-1;室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2kJ,则( )
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
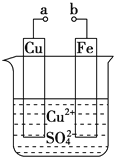
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b用导线连接时,Fe片上发生还原反应,溶液中SO42-向铜电极移动
难度: 简单查看答案及解析
-
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:2H++2e-=H2↑,发生氧化反应
A. ①②③ B. ②④ C. ②③④ D. ③④⑤⑥
难度: 简单查看答案及解析
-
已知空气-锌电池的电极反应为:锌片:2Zn+4OH--4e-=2ZnO+2H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断,锌片是( )
A. 正极,被还原 B. 正极,被氧化
C. 负极,被还原 D. 负极,被氧化
难度: 简单查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为( )
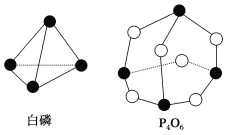
A. -1638kJ/mol B. +1638kJ/mol C. -126kJ/mol D. +126kJ/mol
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=−2 834.9 kJ·mol−1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=−3 119.1 kJ·mol−1
由此得出的正确结论是
A. 等质量的O2比O3能量低,由O2变O3为吸热反应
B. 等质量的O2比O3能量高,由O2变O3为放热反应
C. O3比O2稳定,由O2变O3为吸热反应
D. O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
短周期元素甲乙丙丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )
A. 原子半径:丁>丙>乙>甲
B. 单质的还原性:丁>丙>甲
C. 甲、乙、丙的氧化物均为共价化合物
D. 乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析