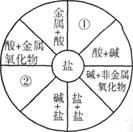
-
下列化肥中,从外观即可与其他化肥相区别的是
A、硝酸钾 B、碳酸铵 C、氯化钾 D、磷矿粉
难度: 中等查看答案及解析
-
下列物质不能用复分解反应制取的是
A.Fe B.CaSO4 C.HNO3 D.Ca(OH)2
难度: 中等查看答案及解析
-
符合健康标准的饮用水的pH在6.5-8.0之间,要使pH低于6. 5的天然水达到饮用水的酸碱度范围,下列处理方法最可行的是
A.加热 B.加入适量纯碱
C.加入适量氯化钡 D.加入适量明矾
难度: 中等查看答案及解析
-
某综合实践活动小组在校外调查时发现了下列一些现象,你认为其中不合理的是
A.生产农作物时,农民按国家标准适量使用化肥、农药
B.城市的“地沟油”经过加工处理后,作为化工原料
C.用亚硝酸钠腌制食品
D.一些农民用熟石灰改良酸性土壤
难度: 中等查看答案及解析
-
下列应用及相应原理(用化学方程式表示)都正确的是
A.用稀盐酸除铁锈 Fe2O3+6HCl=2FeCl2+3H2O
B.用二氧化碳制碳酸饮料 CO2+H2O=H2CO3
C.用电解水的方法测定水的组成 2H2O=2H2↑+O2↑
D.用氢氧化钠制碳酸钠 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
难度: 中等查看答案及解析
-
2008年9月27日,太空第一次留下了“中国人的脚印”。 我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铁反应 D.与氯化铜溶液反应
难度: 中等查看答案及解析
-
在室温下,将下列物质各5g分别放人50g水中,现象最相似的是
A.CaO、CaCl2 B.CuSO4、NaCl
C.CaCO3、BaSO4 D.NaOH、NH4NO3
难度: 中等查看答案及解析
-
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3 B.CO2 → CaCO3
C.MgCl2 → KCl D. Cu → CuCl2
难度: 中等查看答案及解析
-
下列除杂(括号内的是杂质)所选试剂合理的是
A.Cu(Zn) 稀盐酸 B.CO2气体(HCl) 氢氧化钠溶液
C.NaCl(Na2CO3) 硝酸钠 D.CaCl2溶液(HCl)氢氧化钾溶液
难度: 中等查看答案及解析
-
有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④FeCl3,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是
A.④③②① B.④①②③ C.①③④② D.①④②③
难度: 中等查看答案及解析
-
现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有
A.7个 B.6个 C.5个 D.4个
难度: 中等查看答案及解析
-
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如下图所示。则符合该变化的一组物质是

x
y
A
NaOH溶液
稀HCl(过量)
B
稀H2SO4
BaCl2溶液(少量)
C
Ca(OH)2
CO2(适量)
D
Ca(OH)2
Na2CO3
难度: 中等查看答案及解析