-
下列表示方法错误的是
A.S2-的结构示意图:
B.CO2的结构式:O=C=O
C.二氧化硅的分子式:SiO2 D.乙烯的结构简式为CH2=CH2
难度: 简单查看答案及解析
-
将BaCl2溶液分别盛于两支试管中,第1支加入稀HNO3溶液,第2支加入烧碱溶液,然后再分别通入SO2气体,结果两试管均有白色沉淀产生。下列说法正确的是
A.证明SO2具有强氧化性和酸性
B.若第1支试管先通入Cl2,再通SO2气体,也有白色沉淀生成
C.若第2支试管先通入NH3,再通SO2,不会产生沉淀
D.若第1支试管中先加入稀HNO3溶液,再加入Na2SO3溶液,则无沉淀生成
难度: 简单查看答案及解析
-
如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水(此法可快速制备氨气),立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应产生了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥红石蕊试纸不变色,湿润红色石蕊试纸变蓝
NH3是一种可溶性碱
难度: 简单查看答案及解析
-
a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为①(a+b)×189g ②Vc-(9a+b) mol ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
氮化钠和氢化钠分别与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3,NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是
A.离子半径:Na+>N3->H+ B.上述反应都是氧化还原反应
C.与盐酸反应都只生成一种盐 D.加热熔化时,都只破坏离子键
难度: 简单查看答案及解析
-
国际无机化学命名委员会曾在1989年作出决定,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,如第ⅠA族为第1列,零族为第18列。若按照这个规定,下列说法不正确的是
A.第2列元素中肯定没有非金属元素
B.第15列元素的最高价氧化物对应的水化物均为HRO3
C.第17列元素的第一种元素无最高价含氧酸
D.第14列元素形成的化合物种类最多
难度: 简单查看答案及解析
-
下列说法正确的是
A.共价化合物一定属于原子晶体
B.含离子键的一定属于离子化合物,含共价键的一定属于共价化合物
C.氢键理论是由科学家鲍林提出来的
D.在分子晶体中必有共价键和分子间作用力
难度: 简单查看答案及解析
-
已知热化学方程式2SO2(g)+ O2(g)
2 SO3(g) △H=-Q kJ·mol-1(Q>0),则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,正反应速率增大,逆反应速率减小,上述热化学方程式中的Q值减小
D.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
难度: 简单查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g) DH = -72 kJ•mol-1。且知蒸发1mol Br2(l)需要吸收的能量为30kJ,则表中a为(其它相关数据如下表)
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂或形成时吸收或放出的热量
436
a
369
A.404 B.260 C.230 D.200
难度: 简单查看答案及解析
-
某同学为了使反应2HCl + 2Ag
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是

难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)
2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
向5 mL 0.1 mol·L-1 的KI溶液中滴加5~6滴0.1 mol·L-1 的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.1mol 苯中含有碳碳双键的数目为3 NA
D.2.8g聚乙烯中含有的碳原子数为0.2 NA
难度: 简单查看答案及解析
-
下列除去杂质的操作中,不能达到目的的是
A.除去苯中的少量溴:加入CCl4萃取后分液
B.除去乙烷中的乙烯:通入溴水中
C.除去CO2中的少量HCl气体:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入足量Fe粉后过滤
难度: 简单查看答案及解析
-
下列对有机物结构的叙述中不正确的是
A.乙烯、乙炔、溴苯分子中的所有原子均是共平面
B.在有机物分子中,含有的氢原子个数一定是偶数
C.
属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的
D.CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构
难度: 简单查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X能与元素Y形成离子化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物对应的水化物都是强酸
难度: 简单查看答案及解析
-
在25℃、1.01×105Pa下,将22gCO2通入到750mL 1.0mol·L-1的NaOH溶液中充分反应,放出x kJ热量。在该条件下1molCO2通入到2L 1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A.CO2(g) + NaOH(aq) = NaHCO3(aq) △H= - (2y-x) kJ·mol-1
B.CO2(g) + NaOH(aq) = NaHCO3(aq) △H= - (4x-y) kJ·mol-1
C.CO2(g) + NaOH(aq) = NaHCO3(aq) △H= - (2x-y) kJ·mol-1
D.CO2(g) + NaOH(aq) = NaHCO3(aq) △H= - (8x-2y) kJ·mol-1
难度: 简单查看答案及解析
-
如图所示装置,两玻璃管中盛有含酚酞的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),若断开S1,接通S2,电流表的指针发生偏转。下列说法不正确的是

A.接通S1时,C(Ⅰ)的电极名称为阴极
B.接通S1时,直流电源的右边为正极
C.接通S2时,C(Ⅰ)电极反应式为H2-2e-+2OH-=2H2O
D.若将原来的电解质溶液换成含酚酞的MgCl2溶液,接通S1后现象相同
难度: 简单查看答案及解析
-
等质量且完全相同的三份铁a、b和c,分别加入到足量稀H2SO4中,a中同时加入适量CuSO4溶液, c中同时加入适量CH3COONa。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中正确的是
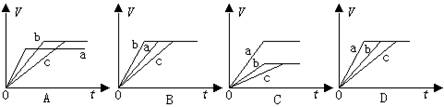
难度: 简单查看答案及解析
-
在一定条件下,萘可与浓硝酸、浓硫酸两种混酸反应生成二硝基化合物,它是1,5-二硝基萘和1,8-二硝基萘的混合物。
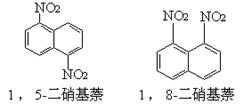
后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这二种异构体分离。在上述硝化产物中加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是
A.对所得的滤液蒸发浓缩冷却结晶 B.向滤液中缓缓加入水后过滤
C.向滤液中缓缓加入Na2CO3溶液后过滤 D.将滤液缓缓加入水中后过滤
难度: 简单查看答案及解析
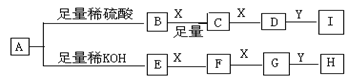
 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式。
