-
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是( )
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
难度: 中等查看答案及解析
-
SO2通入下列溶液中,肯定不会生成沉淀的是( )
A.氯化钡溶液 B.氢氧化钡溶液 C.硫化氢溶液 D.澄清石灰水
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.元素的单质只可由氧化含该元素的化合物来制得
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,只能作氧化剂
D.含有最高价元素的化合物不一定具有强的氧化性
难度: 中等查看答案及解析
-
下列物质能通过化合反应直接制得的是( )
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C. 只有①③④ D.全部
难度: 中等查看答案及解析
-
将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积视为不变)( )
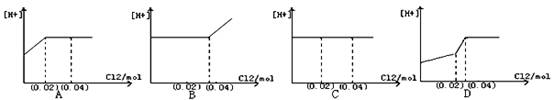
难度: 中等查看答案及解析
-
硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O C.N2、HNO3、H2O D.NH3、NO、H2
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向碘化亚铁溶液中通入少量氯气 2Fe2++Cl2=2Fe3++2Cl-
B.向硫酸氢钠溶液中滴入氢氧化钡溶液至中性 2H++SO
+Ba2++2OH-=BaSO4↓+2H2O
C.向次氯酸钙溶液中通入过量二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.将氢氧化铁粉末加入氢碘酸中 Fe(OH)3+3H+=Fe3++3H2O
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl—、I—
B.pH为1的溶液:Cu2+、Na+、Mg2+、NO3—
C.水电离出来的c(H+)=10—13mol/L的溶液:K+、HCO3—、Br—、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32—、NO3—、Al3+
难度: 中等查看答案及解析
-
某学生设计了如图的方法对A盐进行鉴定:
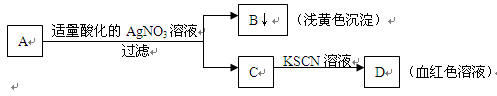
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+ C.B为AgI沉淀 D.A一定为FeBr2溶液
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
B.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
C.100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D.20 g重水(D2O)中含有的电子数为10NA
难度: 中等查看答案及解析
-
单质Ti的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属Ti。由TiO2制金属Ti的反应为( )
① TiO2+2C+2Cl2 ===== TiCl4+2CO ② TiCl4+2Mg ===== 2MgCl2+Ti
则下列叙述正确的是
A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物
B.由反应①可知,可用CO在高温下把TiO2还原成Ti
C.由反应②可知,若有24 g Mg参加反应,就可生成1 mol Ti
D.由反应②可知,金属Mg的还原性比金属Ti的还原性强
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-=BaSO4↓+H2O
B.NaHCO3与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3-
D.CH3COOH溶液与NaOH溶液反应:H++OH-=H2O
难度: 中等查看答案及解析
-
我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是 ( )
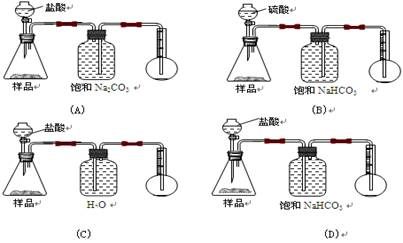
难度: 中等查看答案及解析
-
已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
溶质的质量分数
甲溶液密度/g.cm-3
乙溶液密度g.cm-3
1%
0.95
1.02
5%
0.92
1.04
9%
0.90
1.07
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是( )
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
C.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
难度: 中等查看答案及解析