-
下列设计的实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
证明“84”消毒液的氧化能力随溶液pH的减小而增强
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色
B
证明反应速率会随反应物浓度的增大而加快
用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L﹣1CuSO4溶液,迅速产生较多气泡
C
检验淀粉是否水解
在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸
D
证明SO2有漂白性
将SO2通入酸性高锰酸钾溶液中
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与人类生产、生活密切相关,下列有关说法不正确的是( )
A. “地沟油”禁止食用,但可用来制取肥皂
B. 在厨房里可用米汤检验加碘食盐中的碘
C. 波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害
D. 纤维素在人体内不能水解为葡萄糖
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数.下列说法正确的是( )
A. 1 mol FeCl3完全水解生成的 Fe(OH)3胶粒数为 NA
B. 将 1mol Cl2完全通入水中,HClO、Cl-、ClO -粒子数之和为 2NA
C. 12g石墨中含有3NA个C﹣C共价键
D. 10℃时,1L pH=1.0 的 H2SO4溶液中含 H+为 0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素;X与Z可形成常见的XZ2分子或XZ分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是 ( )
A. 原子半径:W>Z>Y>X>M
B. 由X、Z、M这三种元素组成的物质一定是有机物
C. XZ2、X2M2均为直线形的共价化合物
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键
难度: 中等查看答案及解析
-
迷迭香酸是从蜂花属植物中提取到的酸性物质,其结构如下图所示.下列叙述正确的是( )

A. 迷迭香酸的分子式为C18H14O8
B. 该物质能使溴水或高锰酸钾溶液褪色,不能与FeCl3溶液发生显色反应
C. 1mol迷迭香酸跟H2反应,最多消耗9molH2
D. 1mol迷迭香酸与足量NaOH溶液反应,最多消耗6molNaOH
难度: 中等查看答案及解析
-
金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
难度: 困难查看答案及解析
-
已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7 Ka2=4.7×10-11
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )

A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中
 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)D. 图像中a点酸的总浓度大于b点酸的总浓度
难度: 困难查看答案及解析

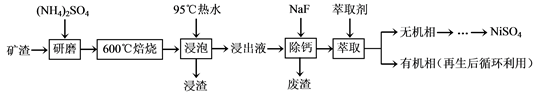
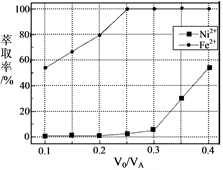

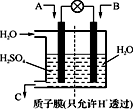
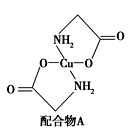
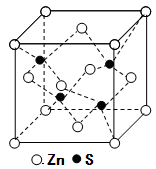
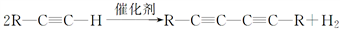
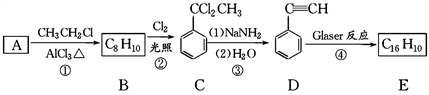
 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。