-
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3其核磁共振谱中给出的峰值(信号)有两个,如右图所示:

下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是( )
A.CH3CH2 OH B.CH3COOH
C CH3COOCH3 D. CH3OCH3
难度: 简单查看答案及解析
-
已知一定条件下断裂1mol下列化学键需要吸收的能量分别为:H-H 436 kJ;
Cl—Cl 243 kJ;H—Cl 431 kJ。对于反应 H2(g)+ Cl2 (g) =" 2HCl" (g),
下列说法正确的是( )
A.该反应的反应热 ?H > 0
B.氢气分子中的化学键比氯气分子中的化学键更稳定
C.相同条件下,该反应在光照和点燃条件下的?H不同
D.H2与Cl2反应的热化学方程式为 H2(g) +Cl2(g) = 2HCl(g)?H =" -183" kJ
难度: 简单查看答案及解析
-
一定条件下,可逆反应N2 +3H2
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D.增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆增大倍数;N2 转换率减小,H2转化率增大
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△S<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g)
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和
V(NH3)均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应
难度: 简单查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热, Kw增大,pH不变
难度: 简单查看答案及解析
-
下列有关实验操作不正确的是 ( )
A.中和热的测定实验中用到的玻璃仪器有温度计、烧杯、环形玻璃搅拌棒
B.滴定管在使用前必须检验是否漏水
C.某次滴定后滴定管的读数为20.3ml
D.碱式滴定管不能量取盐酸的体积
难度: 简单查看答案及解析
-
在室温下,下列叙述正确的是( )
A.将1 mL 1.0×10-5 mol/L盐酸稀释到1000 mL,得到pH=8 的盐酸
B.将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1 mL pH="13" NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,2 c(Cl— )=c(SO42— )
难度: 简单查看答案及解析
-
下列关于有机物说法不正确的是( )
A.2,2-二甲基丙醇和2-甲基-1-丁醇互称为同分异构
B.沸点比较:乙醇>丙烷>乙烷
C.
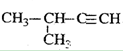 命名为3-甲基-1-丁炔
命名为3-甲基-1-丁炔D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键
难度: 简单查看答案及解析
-
在25℃、101kPa 下:①2Na(s) +1/2O2(g)=Na2O(s) △H1=-414KJ/mol;
②2Na(s) +O2(g)=Na2O2(s) △H2=-511KJ/mol。下列说法不正确的是( )
A.①和②生成等物质的量的产物,转移电子数相同
B.①和②说明Na2O2比Na2O稳定
C.①和②产物的阴阳离子个数比不相等
D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
难度: 简单查看答案及解析
-
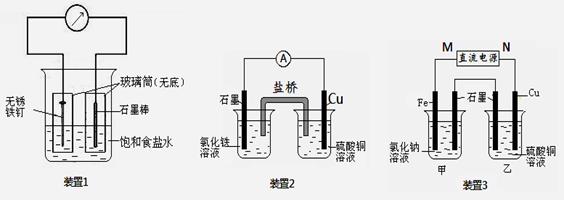
关于下列各装置图的叙述不正确的是( )


① ② ③ ④
A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 简单查看答案及解析
-
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X
Y
W
n(起始状态)/mol
2
1
0
n(平衡状态)/mol
1
0.5
1.5
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH >0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是K=
难度: 简单查看答案及解析
-
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是:( )

A.P1>P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
难度: 简单查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+) >c(OH-)>c(HCO3-) >c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(Na+) -c(HCO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(Na+)+c(H+) =c(OH-) +c(HCO3-) +c(CO32-)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]: c(CH3COO-) =0.1 mol·L-1
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法不正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由连接M改为连接N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Pt上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化性引起的
难度: 简单查看答案及解析
-
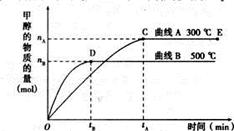
在一密闭容器中进行如下反应:2SO2(气)+O2(气)
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
A.SO2为0.3mol/L、O2为0.2mol/L B.SO2、SO3均为0.15mol/L
C.SO3为0.4mol/L D.SO2为0.25mol/L
难度: 简单查看答案及解析
-
为了便于酒驾测试,生产了一种基于酸性燃料电池原理设计的酒精检测仪,
电池总反应式为:CH3CHO+O2=CH3COOH+H2O。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+
D.正极上发生的反应是:O2+4e-+2H2O=4OH-
难度: 简单查看答案及解析
-
向20 mL NaOH溶液中逐滴加入0.1 mol/L醋酸溶液,滴定曲线如右图所示。下列判断正确的是( )

A.在M点,两者恰好反应完全
B.滴定前,酸中c(H+) 等于碱中c(OH-)
C.NaOH溶液的物质的量浓度为0.1 mol/L
D.在N点,c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)
难度: 简单查看答案及解析