-
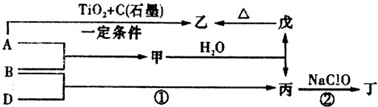
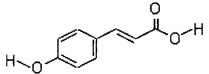
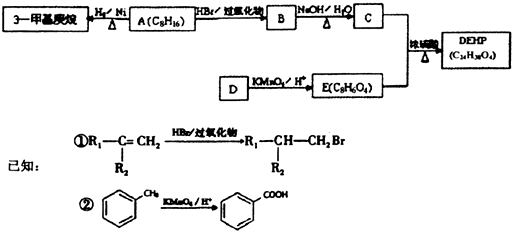
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
A.原子半径:D>B>E>C>A
B.单质D可用海水作原料获得
C.热稳定性:EA4>A2C
D.化合物DC与化合物EC2中化学键类型相同难度: 中等查看答案及解析
-
化学已经渗透到人类生活的各个方面,下列说法正确的是( )
A.垃圾焚烧不仅可以用于发电,还不会带来任何新污染
B.喂养鸡的过程中大量使用抗生素,大量进食这样的鸡肉对人体健康有益
C.油脂在人体内水解为氨基酸和甘油等小分子被吸收
D.铜具有良好的导电性,常用来制作印刷电路板难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418OH-+O2↑
B.Fe3O4与稀硝酸反应:Fe3O4+8H+═2Fe3++Fe2++4H2O
C.向含有0.4 mol FeBr2的溶液中通入0.5 mol Cl2充分反应:4Fe2++8Br-+5Cl2═4Fe3++10Cl-+4Br2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO+6H++2MnO4-═5SO
+2Mn2++3H2O
难度: 中等查看答案及解析
-
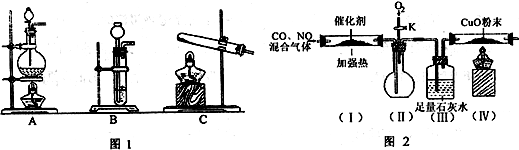
下列装置或实验操作正确的是( )
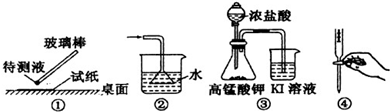
A.①用pH试纸测某溶液的酸碱性
B.②吸收氨气制氨水
C.③探究氧化性:KMnO4>Cl2>I2
D.④中和滴定实验难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,则下列说法正确的是( )
A.电解精炼铜时,若阴极得到电子数为2 NA,阳极质量减少64g
B.200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5 mol/L
C.常温常压下,78g Na2O2固体中所含阴、阳离子总数为4 NA
D.一定条件下,足量的Fe粉与浓硫酸反应,转移电子数一定为2 NA难度: 中等查看答案及解析
-
下列有关溶液中粒子浓度的关系式正确的是( )
A.25℃时,0.1 mol•L-1pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B.向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+-c(HCO3-)
C.常温下,NH4Cl和NH3•H2O的混合溶液[pH=7,c(C1-)=0.l mol/L]中:c(Cl-)>c(NH4+)>c(OH-)=c(H+)
D.浓度均为0.1 mol•L-1的CH3COONa和CH3COOH的混合溶液中:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]难度: 中等查看答案及解析