-
下列化学药品与其危险化学品图形标志不一致的一组是( )
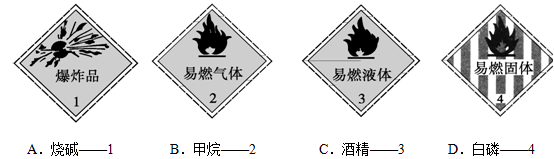
难度: 简单查看答案及解析
-
关于摩尔的说法是正确的是( )
A.摩尔是表示物质数量的单位
B.摩尔是表示物质多少的单位
C.摩尔是既表示物质所含粒子数的数量,又能表示物质的质量具有双重意义的单位
D.摩尔是巨大数目的粒子集合体,表示物质的量的国际单位
难度: 简单查看答案及解析
-
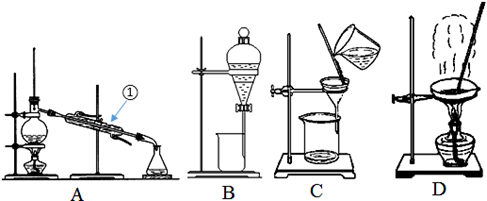
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙
A. ③⑥⑦ B. ①⑤⑥ C. ①⑤ D. ⑤⑥⑦
难度: 简单查看答案及解析
-
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
难度: 中等查看答案及解析
-
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
B. 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下
C. 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
难度: 简单查看答案及解析
-
a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.
mol-1 B.
mol-1 C.
mol-1 D.
mol-1
难度: 中等查看答案及解析
-
现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 过滤 B. 蒸发 C. 分液 D. 萃取
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
难度: 中等查看答案及解析
-
同温同压下,下列气体的密度最大的是 ( )
A.氢气 B.二氧化硫 C.氧气 D.二氧化碳
难度: 中等查看答案及解析
-
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2 ; ②KCl ; ③NaOH ; ④CuSO4 ;⑤Na2SO4。如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是( )
A.④③①⑤② B.④②③⑤① C.①⑤③④② D.③④①⑤②
难度: 中等查看答案及解析
-
已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
难度: 简单查看答案及解析
-
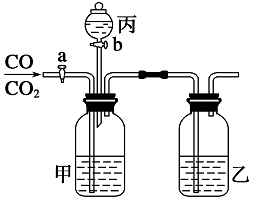
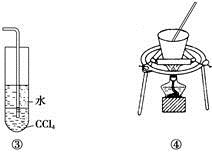
下列装置或操作能达到实验目的的是( )
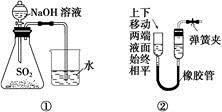
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 装置②可证明装置的气密性良好
C. 装置③可用于吸收NH3或HCl气体,并防止倒吸
D. 装置④可用于实验室从食盐水中提取氯化钠
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,4g H2含有的分子数为 2NA
B.8g H2O在标准状况下的体积是22.4L
C.2.3g金属钠变为钠离子时失去的电子数为NA
D.17g氨气所含电子数目为8NA
难度: 中等查看答案及解析
-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤。正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
难度: 困难查看答案及解析
-
标准状况下,m g气体A与n g气体B分子数相同,下列说法中不正确的是( )
A.气体A与B的相对分子质量比为m∶n
B.同质量气体A与B的分子个数比为n∶m
C.同温同压下,同体积A气体与B气体的密度比为n∶m
D.相同状况下,同体积A气体与B气体质量比为m∶n
难度: 中等查看答案及解析
-
除去下列物质中少量杂质(括号内为杂质),所用试剂或方法错误的是( )
A.NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶
B.CO(水蒸气)通过浓硫酸的洗气瓶
C.CaO固体(CaCO3)高温煅烧
D.KCl固体(MnO2)溶解、过滤、蒸发
难度: 中等查看答案及解析
-
下列条件下,两瓶气体所含原子数一定相等的是( )
A.同压强、同体积的N2O和CO2 B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同质量、不同密度的N2和CO
难度: 中等查看答案及解析
-
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
关于0.1 mol/L H2SO4溶液的叙述错误的是( )
A.1 L该溶液中含有H2SO4的质量为9.8 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L
C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 mol/L
难度: 简单查看答案及解析