-
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是
A.Li2NH中N的化合价为-1
B.此法储氢和钢瓶储氢的原理相同
C.LiH中的阳离子半径大于阴离子半径
D.该反应中H2既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2 (g) +2H2O(g) △H1=- 574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—1160kJ·mol-1
下列选项正确的是
A.CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= - 867kJ·mol-1
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3,
则△H3>△H1
C.若用0.2molCH4还原NO2至N2,则反应中放出的热量一定为173.4kJ
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol
难度: 简单查看答案及解析
-
脑白金主要成分的结构简式如下图所示,对脑白金主要成分的推论正确的是
A. 其分子式为C13H15N2O
B. 该物质能发生水解反应并生成乙酸
C.该物质不能与溴水反应
D.其官能团与氨基酸相同
难度: 简单查看答案及解析
-
常温时,将V1mL c1 mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列正确的是
A. 若混合溶液的pH=7,则溶液中c (NH4+)> c (Cl—)
B.若V1=V2,c1=c2,则溶液中一定存在c(H+)= c (OH—),呈中性
C. 若混合溶液的pH=7,则一定存在c1V1>c2V2 关系
D.若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的
难度: 简单查看答案及解析
-
如右图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是
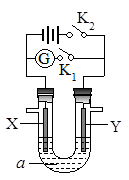
A.合上K1、断开K2,该装置可以将化学能转变为电能
B.合上K2、断开K1,一段时间后,湿润的KI淀粉试纸靠
近Y电极管口,试纸变蓝
C.合上K1、断开K2,溶液中阴离子向Y电极定向移动
D.合上K2、断开K1,一段时间后,X电极附近溶液呈红色
难度: 简单查看答案及解析
-
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如右图。下列说法正确的是
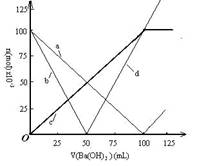
A.曲线a表示H+的物质的量的变化
B.直线d表示OH-的物质的量的变化
C.曲线c表示Ba2+的物质的量的变化
D. 加入Ba(OH)2溶液50mL反应的离子方程式为
Ba2++OH-+H++SO42-= BaSO4↓+H2O
难度: 简单查看答案及解析
-
一定量的Zn与一定浓度的H2SO4反应,生成气体在标准状况下体积为2.24L。下列关于反应消耗的H2SO4的物质的量的推测肯定正确的是
A.n(H2SO4)=0.1mol B.n(H2SO4)=0.2mol
C.0.1mol<n(H2SO4) <0.2mol D.0.1mol≤n(H2SO4)≤0.2mol
难度: 简单查看答案及解析
-
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体。E是地壳中含量居第二位的金属。D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素。有关的转化关系如下图所示(反应条件均已略去):
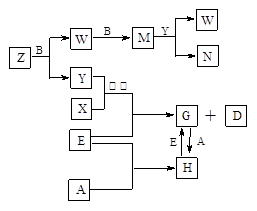
(1)A的化学式为________,B的化学式为________,C的电子式为。
(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为________。
(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:
。
(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”)________7,用离子反应方程式表示其原因为________。
难度: 简单查看答案及解析
-
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
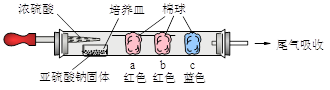
棉球
棉球上滴加试剂
实验现象
解释或结论
a
_______________
棉球变白,微热后又恢复红色
解释:__________________
结论:该气体具有漂白性。
b
含酚酞的NaOH溶液
棉球变为白色
离子方程式:
_________________________
c
淀粉和___________的混合溶液
棉球变为白色
化学方程式:_________________
结论:该气体具有_________性。
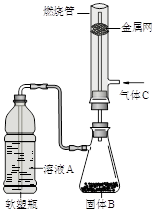 (2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
溶液A
固体B
气体C
a.
稀硫酸
Zn
Cl2
b.
浓盐酸
MnO2
H2
c.
稀硝酸
Fe
Cl2
d.
浓盐酸
KMnO4
H2
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓烈的黑烟,则固体B为_________(填化学式)。此火焰温度极高,常用于切割焊接金属。
难度: 简单查看答案及解析
-
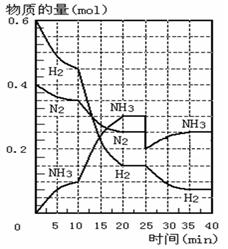
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如右图所示,分析图像完成下列填空:
(1)0—10分钟,N2的平均反应速率为 ___________mol·L-1·min-1, 0—10分钟与10到20分钟两个时间段中,N2的反应速率之比为_________。反应在第10min可能改变的条件是____________,运用图像信息说明该条件不是升温的原因是____________。
(2)计算500℃时,反应N2+3H2
2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
(3)在图中画出25min—40min时间段内N2的物质的量的变化图像。
难度: 简单查看答案及解析
-
工业上以黄铁矿为原料生产硫酸。
(1)写出燃烧黄铁矿的化学方程式________。
(2)接触室中发生反应的化学方程式是________。
(3)判断下列说法正确的是(选填序号字母)________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔中用浓硫酸吸收三氧化硫而不用水的原因是是 ________。
(5)吸收塔排出的尾气可以用两种方法处理:
方法①:先用氨水吸收,再用浓硫酸处理。用浓硫酸处理的主要目的是 ________ ;
方法②:先用含一定水的亚硫酸钠吸收后再加热处理,也可达到与方法①相同的目的。为了实现节能减排,其所需能量可以由________提供。与方法①相比,方法②的优点是________。
(6)SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是________。
难度: 简单查看答案及解析
-
已知:①双键在链端的烯烃发生硼氢化-氧化反应,生成的醇羟基在链端:
②
化合物M是一种香料,可用如下路线合成:
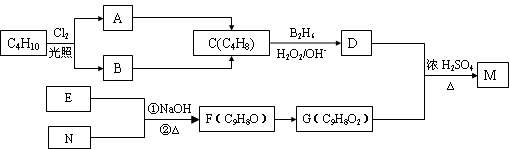
已知:核磁共振氢谱显示E分子中有两种氢原子。F为芳香化合物。
请回答下列问题:
(1)原料C4H10的名称是__________(系统命名);
(2)写出反应A→C的反应条件: __________;
(3)D也可由C与水蒸气在一定条件下合成。这种制法与题给反应条件相比,缺点是_____________________________;
(4)F与新制Cu(OH)2反应的化学方程式__________________________;
(5)写出E、N、M的结构简式____________、____________、______________;
(6)写出与G具有相同官能团的G的所有芳香类同分异构体的结构简式:
难度: 简单查看答案及解析
-
发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化。
(1)根据等电子原理,写出CO分子的结构式________。
 (2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式。
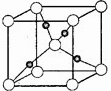
(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式。(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为________。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是________。
(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,
甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子中碳原子轨道的杂化类型为________; 1mol甲醛分子中σ键的数目为。
难度: 简单查看答案及解析