-
下列设备工作时,将化学能转化为热能的是到

难度: 简单查看答案及解析
-
下列化学用语或图示表达正确的是
A.乙烯的比例模型
B.Na+的结构示意图
C.葡萄糖的实验式C6H12O6
D.CO2的电子式
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
难度: 中等查看答案及解析
-
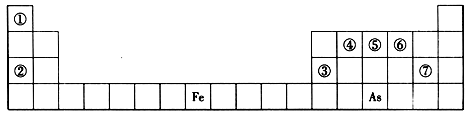
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
A.原子半径由小到大的顺序:X< Y < Z< W
B.Z的最高价氧化物能与水反应生成相应的酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、 Y3+ C. Y3+、 Z2- D. X+、 Z2-
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.1 mol 过氧化钠中阴离子个数为2×6.02×1023
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023
C.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
难度: 中等查看答案及解析
-
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O— MnO4- + SO42- H+
对上述两个反应判断正确的是:
A.①②反应中SO42—都是氧化产物
B.两个反应中电子转移数目都是10mol
C.①反应中的硫元素既被氧化又被还原
D.氧化性:MnO4—> S2O82—
难度: 中等查看答案及解析
-
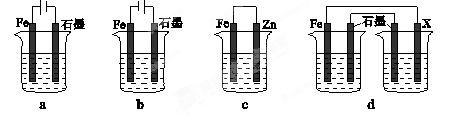
下列与金属腐蚀有关的说法正确的是

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 中等查看答案及解析
-
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是

A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e-====HCOOH
难度: 中等查看答案及解析
-
已知:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
A.10min后,升高温度能使
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1•min-1
难度: 中等查看答案及解析
-
在一个绝热的密闭反应器中,只发生两个反应:
a(g)+b(g)
2c(g);ΔH1<0
x(g)+3y(g)
2z(g);ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
A. 等容时,通入惰性气体,各反应速率不变
B.等容时,通入z气体,y的物质的量浓度增大
C.等压时,通入z气体,反应器中温度升高
D.等压时,通入惰性气体,c的物质的量不变
难度: 困难查看答案及解析
-
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
A.Na2O2和NaHCO3 B.NaHCO3和Na2CO3
C.NaOH和Na2CO3 D.只有Na2CO3
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
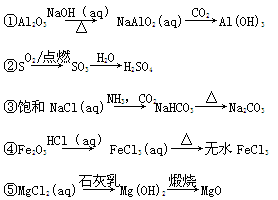
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
下图所示的实验,能达到实验目的的是
A B C D
验证化学能
转化为电能 证明温度
对平衡移动的影响 验证铁
发生析氢腐蚀 验证AgCl
溶解度大于Ag2S
难度: 中等查看答案及解析