-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及实验现象
结论
A
室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去
溶液中含有Fe2+,不含Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊
Na2O2已经变质
D
向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀
Ksp(AgCl)<Ksp(Ag2CrO4)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A. “绿水青山就是金山银山”,矿物燃料的脱硫脱硝,可以减少SO2、NO2 的排放
B. 2017 年11月5 日,发射北斗三号全球导航卫星计算机的芯片材料是高纯度二氧化硅
C. 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D. 2M +N=2P+2Q,2P+M=Q(M、N 为原料,Q为期望产品),不符合绿色化学的理念
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 四氯化碳分子的球棍模型:
 B. 氢硫酸的电离:H2S
B. 氢硫酸的电离:H2S2H++S2-
C. 氯化铵的电子式:
D. 含78 个中子的碘原子:
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥气体
B. FeCl3溶液水解呈酸性,可用作铜制线路板的蚀刻剂
C. 铜比铝活动性弱,可用铜罐代替铝罐贮运浓硝酸
D. ClO2 具有强氧化性,可用于消毒杀菌
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2 与足量NaOH 反应转移的电子数为0.25NA
B. 室温下,1LpH=13 的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L( 标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3
2HNO3 +4N2↑+9H2O 反应中,生成56gN2 时,转移的电子数目为3.75NA
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A. Fe2+、Fe3+共存时,检验Fe2+:Fe3+ +3SCN- =Fe(SCN)3↓
B. 向次氯酸钙溶液通入过量CO2 :Ca2+ +2C1O- +H2O +CO2=CaCO3↓+2HClO
C. 除去MgO中少量的Al2O3 杂质:Al2O3 +6H+=2Al3+ +3H2O
D. Fe 与稀硝酸反应,当n(Fe): n(HNO3)= 1:2 时:3Fe +2NO3-+8H+=3Fe2++2NO ↑+4H2O
难度: 中等查看答案及解析
-
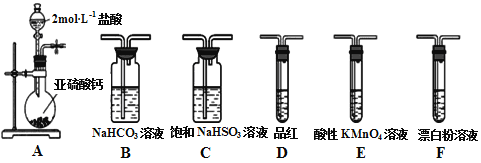
下列有关实验装置进行的相应实验,能达到实验目的的是
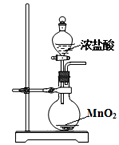
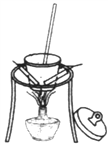
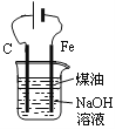
图1 图2 图3 图4
A. 用图1装置制取氯气
B. 用图2所示装置可除去纯碱中的小苏打
C. 用图3所示装置可分离乙醇和饱和碳酸钠溶液
D. 用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 反应MgO(s) +C(s)=Mg( s) +CO(g) 在室温下不能自发进行,则该反应的△H>0
B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力
C. 0.1mol.L CH3COOH 溶液加水稀释后,溶液中
值减小
D. 锅炉中沉积的CaSO4 可用饱和Na2CO3 溶液浸泡,再将不溶物用稀盐酸溶解除去
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
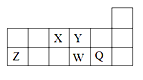
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 简单查看答案及解析
-
对下列有机化学的认识中,错误的是
A. 反应
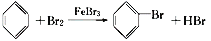 属于取代反应
属于取代反应B. 淀粉和纤维素属于多糖,在人体内水解转化为葡萄糖,为人类提供能量
C. 分枝酸结构简式如图
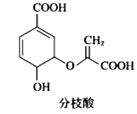 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色D. 取蔗糖水解液少许,先滴加过量的NaOH溶液,再滴入新制的氢氧化铜悬浊液,加热,有红色沉淀生成,证明其水解产物具有还原性
难度: 中等查看答案及解析
-
A、B、C三种常见物质中均含有同一种元素,它们之间有如图所示的转化关系(部分反应物质已略去)。下列说法不正确的是
A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A为一种金属单质时,则反应①、②、③均可为化合反应,反应④可为置换反应
C. 若A、B、C是三种不同类别的固态物质,则B可以是工业上制取A、C的原料
D. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,则将C通入A溶液中,pH值先减小后增大
难度: 困难查看答案及解析
-
Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。
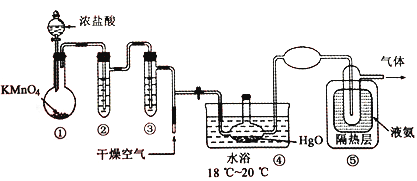
已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
难度: 困难查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1 mol·L-1,某同学进行了如下实验: 下列说法正确的是
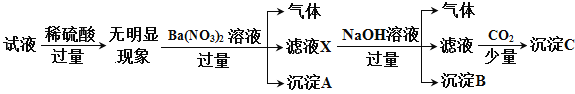
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
难度: 中等查看答案及解析
-
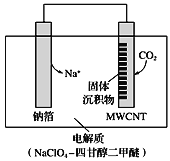
高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是
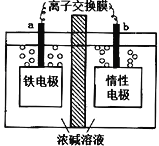
A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析
-
将0.2mol/L的KI溶液和0.05mol/LFe2(SO4)3 溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-=2Fe2++I2 的是
A. 向混合液中滴入KSCN 溶液,溶液变红色
B. 向混合液中滴入AgNO3 溶液,有黄色沉淀生成
C. 向混合液中滴入K3[Fe(CN)6]溶液,有蓝色沉淀生成
D. 向混合液中滴入淀粉溶液,溶液变蓝色
难度: 中等查看答案及解析
-
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
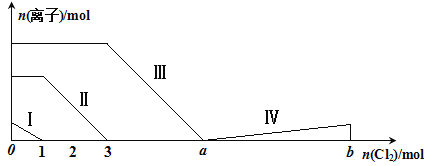
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
难度: 困难查看答案及解析