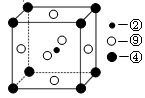
-
下列各组分子中,都属于含极性键的非极性分子的是
A. CO2 H2O2 B. C2H4 CH4 C. C60 C2H4 D.NH3 HCl
难度: 中等查看答案及解析
-
新华网达卡2010年8月6日电(记者粘轶锋)为了解决生活用水问题,孟加拉政府在国际援助机构帮助下在全国各地打了数百万口深层管井,后来使用这些深层管井的居民逐渐开始出现砷中毒症状。经专家调查发现,孟加拉国土壤深层自然形成的砷含量非常高,目前数千万民众受到砷污染威胁。下列有关说法正确的是
A.砷(As)位于周期表第4周期第ⅤA族 B.气态氢化物稳定性:AsH3>PH3>NH3
C.含氧酸酸性:H3AsO4>HNO3>H3PO4 D.氢化物沸点:AsH3>PH3 >NH3
难度: 中等查看答案及解析
-
已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是
A. LiOH加热时,不会分解 B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2 D.Li与稀硫酸反应生成Li2SO4
难度: 中等查看答案及解析
-
能够用键的强度解释的是
A.N2的化学性质比O2稳定 B.HNO3易挥发,H2SO4难挥发
C.常温、常压下,溴呈液态,碘呈固态 D.稀有气体很难发生化学反应
难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
实 验 事 实
理 论 解 释
A.
SO2溶于水形成的溶液能导电
SO2是电解质
B.
白磷为正四面体分子
白磷分子中P—P间的键角是109°28′
C.
1体积水可以溶解700体积氨气
氨是极性分子且由于有氢键的影响
D.
HF的沸点高于HCl
H—F的键长比H—Cl的键长短
难度: 中等查看答案及解析
-
已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.离子半径 C2—>D—>B+>A2+
C.原子序数 d>c>b>a D.单质的还原性 A>B>D>C
难度: 中等查看答案及解析
-
下列说法中正确的是
A.C60气化和金刚石熔化克服的作用力相同
B.甲酸甲酯的熔点低于乙酸的熔点
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.分子晶体的熔沸点低,常温下均呈液态或气态
难度: 中等查看答案及解析
-
已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是
A.A、B、D不可能在同周期 B.C和D的单质可能化合为离子化合物
C.D一定在第二周期 D.A、D可能在同一主族
难度: 中等查看答案及解析
-
主族元素X的原子最外电子层中具有最多的未成对电子,元素Y的原子只有两种形状的电子云,且两种电子云的电子数相等,则X、Y组成的微粒中,不可能存在的是
A.X2Y5 B.
C.
D.
难度: 中等查看答案及解析
-
具有下列电子层结构的原子,其对应元素一定属于同一周期的是
A.两种原子的最外电子层上全部都是s电子
B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.M层上的s能级和p能级都填满了电子,而d轨道上尚有电子的两种原子
难度: 中等查看答案及解析
-
2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺,下列关于三聚氰胺分子的说法中正确的是

A.一个分子中共含有15个σ键
B.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
难度: 中等查看答案及解析
-
下列说法中正确的是:①所有基态原子的核外电子排布都遵循构造原理 ②同一周期从左到右,元素的第一电离能、电负性都是越来越大 ③分子中键能越大,表示分子拥有的能量越高④所有的配合物都存在配位键,所有含配位键的化合物都是配合物 ⑤所有含极性键的分子都是极性分子 ⑥熔融状态下能导电的化合物一定是离子化合物⑦所有的原子晶体都不导电
A.①② B.①⑥ C.③④⑤ D.⑥
难度: 中等查看答案及解析
-
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
A.硝酸钠和金刚石 B.晶体硅和水晶
C.冰和干冰 D.苯和酒精
难度: 中等查看答案及解析
-
氯化硼BCl3的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是
A. 氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采用sp杂化
C. 三氯化硼遇水蒸气会产生白雾
D. 氯化硼分子呈平面正三角形,属非极性分子
难度: 中等查看答案及解析
-
下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.醋酸易溶于水,而乙烷易溶于四氯化碳
难度: 中等查看答案及解析
-
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
A.H2S中的分子间作用力和H2O中的分子间作用力
B.只含σ键的化合物和含有π键的化合物
C.1mol石墨中碳碳单键的个数和1mol金刚石中碳碳单键的个数
D.氨分子中N—H键的极性和甲烷分子中C—H键的极性
难度: 中等查看答案及解析
-
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
难度: 中等查看答案及解析
-
已知CsCl晶体的密度为
,NA为阿伏加德罗常数,相邻的两个
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为


难度: 中等查看答案及解析
-
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是
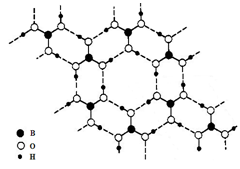
A. H3BO3分子的稳定性与氢键无关
B.H3BO3的结构类似石墨,所以熔点很高
C.分子中硼原子最外层为8e-稳定结构
D.正硼酸晶体属于原子晶体
难度: 中等查看答案及解析
-
下列关于晶体的说法正确的组合是
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、、H2O、H2S晶体的熔点依次降低
④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
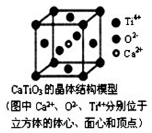
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠溶于水时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
难度: 中等查看答案及解析
-
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是

A.高聚氮晶体属于分子晶体
B.高聚氮晶体中每个N原子和另外3个N原子相连
C.高聚氮转变成氮气是氧化还原反应
D.高聚氮可能成为炸药
难度: 中等查看答案及解析
-
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.三种元素的最高价氧化物对应水化物均可由化合反应得到
C.A的氢化物稳定性大于C的氢化物稳定性
D.B 和A的最高价氧化物可发生置换反应
难度: 中等查看答案及解析
-
气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……右表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。 下列说法正确的是
元素
I1/eV
I2/eV
I3/eV
甲
5.7
47.4
71.8
乙
7.7
15.1
80.3
丙
13.0
23.9
40.0
丁
15.7
27.6
40.7
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙一定为非金属元素 D.丁一定是金属元素
难度: 中等查看答案及解析