-
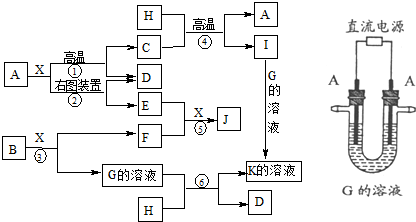
下列实验过程中,通常不需要使用玻璃棒的是( )
①用pH试纸测定Na2CO3溶液的pH
②将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③从氯酸钾和二氧化锰制取氧气的剩余物中提取KCl
④探究Ba(OH)2•8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液
⑥用适量的蔗糖、浓硫酸和水在小烧杯中做浓硫酸的脱水性实验
⑦用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2.
A.②③⑦
B.②⑤⑦
C.②④⑤
D.②④⑥难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4的质量分数为9.8%
B.在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.一定温度下,1L0.50mol•L-1NH4Cl溶液与2L0.25mol•L-1NH4Cl溶液含NH+4物质的量不同难度: 中等查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-难度: 中等查看答案及解析
-
2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA族,可推知氮化镓化学式Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜材料-[CH2-CH2-CF2-CF2]n-是纯净物难度: 中等查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3
B.Na2O2 Na2CO3
C.NaOH Na2CO3
D.Na2O2 NaOH Na2CO3难度: 中等查看答案及解析
-
常温下,向20升真空容器中通入a摩尔H2S和b摩尔Cl2(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最大密度是( )
A.19.45克/升
B.18.25克/升
C.17.85克/升
D.35.5克/升难度: 中等查看答案及解析
-
右图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入agM和agN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是( )
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液
C.t2℃时,M、N的物质的量浓度一定相等
D.t1℃时,M、N的溶质质量分数一定相等难度: 中等查看答案及解析
-
向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,洗涤干燥后将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到VL气体.如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
A.M(OH)2溶液的物质的量浓度
B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量
D.题给条件充足,不需要再补充数据难度: 中等查看答案及解析
-
1L某混合溶液中,溶质X、Y的浓度都为0.1mol•L-1,向混合溶液中滴加某溶液Z至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
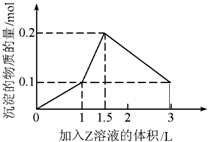
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸难度: 中等查看答案及解析
-
有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )
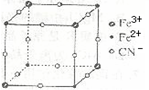
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个难度: 中等查看答案及解析
-
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+216kJ/mol;CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是( )
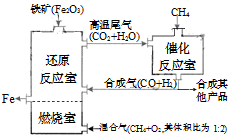
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol,n(H2)=cmol,则通入催化反应室的CH4的物质的量为a+(b+c)/4难度: 中等查看答案及解析
-
某同学用回收的镁铝合金制取氢气.现有l0.8g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O
C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32-
D.用饱和纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5O-难度: 中等查看答案及解析
-
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mLbmol•L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-)
难度: 中等查看答案及解析