-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下的33.6L氯气与足量铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.在1molNa2O2晶体中阳离子与阴离子总数为4NA难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与 F同主族,E与F同周期.已知常温下单质A与E的状态:不同,D原子的核电荷 数是B原子最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.元素的非金属性由强到弱的顺序是:D>C>F>B难度: 中等查看答案及解析
-
2007年诺贝尔化学奖授予德国化学家格哈德•埃特尔,以表彰他在界面化学研究领域取得的成就.下面实例中涉及到的变化都属于“界面化学”的范畴.其中正确的是( )
A.在汽车上安装催化转化器,使一氧化碳在催化剂表面氧化为二氧化碳,可减少一氧化碳的排放
B.泄漏在海洋中的原油可被海洋生物迅速分解而除去
C.铁生锈是铁与空气中的氧气、水蒸气直接化合生成了水合氧化铁(Fe2O3,Nh2O)的结果
D.放置在空气中澄清石灰水表面出现的白色固体的主要成分是氢氧化钙难度: 中等查看答案及解析
-
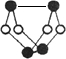
研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,
分子结构如图.下列有关奥司他韦的说法中正确的是( )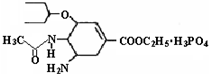
A.含极性键,易溶于水,其水溶液有丁达尔效应
B.分子中含有酯基、氨基、苯环等官能团
C.1mol该物质最多能与3molNaOH反应
D.可以发生加成、取代、氧化反应难度: 中等查看答案及解析
-
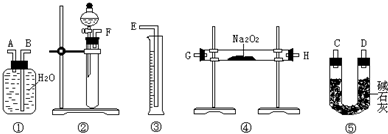
下列实验装置设计正确,且能达到目的是( )
A.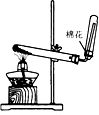
实验室制氨气
B.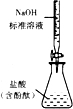
测定盐酸浓度
C.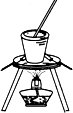
从食盐水中提取NaCl
D.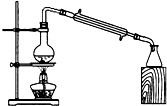
石油的分馏难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O32-是还原剂
D.每有1molO2参加反应,转移的电子总数为4mol难度: 中等查看答案及解析
-
将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为( )
A.0.11mol/L
B.0.22mol/L
C.0.011mol/L
D.0.022mol/L难度: 中等查看答案及解析