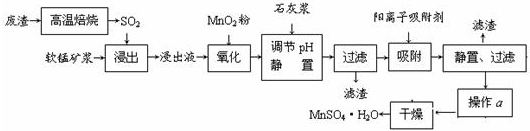
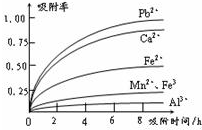
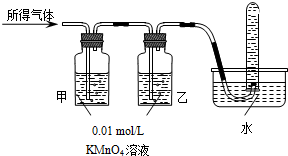
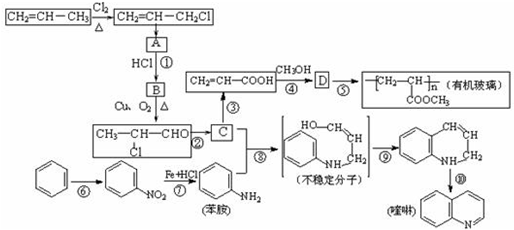
-
下列观点错误的是( )
A.构成物质微粒的种类和数量不同、彼此的结合方式多样,决定了物质的多样性
B.分子是保持物质化学性质的最小粒子,如果分子的组成或结构变了,其化学性质就变了
C.构成物质的微粒之间存在多种形式的相互作用,如离子键、共价键等等
D.储存在物质中的化学能在化学反应前后是不变的难度: 中等查看答案及解析
-
下列说法正确的是( )
A.聚氯乙烯保鲜膜最适合用来包装蔬菜、水果及熟食
B.石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物,没有固定的熔点
C.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
D.乙酸乙酯的水【解析】
CH3COOCH2CH3+H218OCH3COOH+CH3CH218OH
难度: 中等查看答案及解析
-
下列排列顺序正确的是( )
A.固体热稳定性:Na2CO3>CaCO3>NaHCO3
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.给出质子的能力:CH3COOH>C2H5OH>H2O
D.氢化物的沸点:H2Se>H2S>H2O难度: 中等查看答案及解析
-
在以下物质间的多步转化过程中,其中含有不能通过一步反应实现的是( )
A.Fe→FeCl2→Fe(OH)2→Fe(OH)3
B.Al→Al2O3→Al(OH)3→NaAlO2
C.S→SO2→H2SO4→MgSO4
D.N2→NO→NO2→HNO3难度: 中等查看答案及解析
-
在给定条件的水溶液中一定能大量共存的离子组是( )
A.能与Na反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.存在多量Fe2+的溶液:H+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、Cl-、NO3-
D.c(H+):c(OH-)=1:2的溶液:K+、Ba2+、ClO-、CO32-难度: 中等查看答案及解析
-
图中,两电极上发生的电极反应为:a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+,下列说法中不正确的是( )
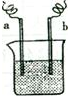
A.该装置可能是电解池
B.a极上发生的是还原反应
C.a、b可能是同种电极材料
D.该装置在工作时,溶液中的阳离子可能向b极移动难度: 中等查看答案及解析
-
在一密闭容器中有如下反应:aX(g)+bY(g)⇌nW(g);△H=Q.某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
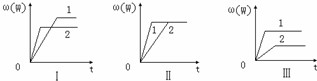
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条 件不变时,下列分析正确的是( )
(1)图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
(2)图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
(3)图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
(4)图Ⅱ可能是在同温同压下催化剂对反应的影响,且1中使用的催化剂效果好.
A.(1)(2)
B.(1)(3)
C.(2)(4)
D.(1)(4)难度: 中等查看答案及解析