-
同种元素的不同微粒,它们的( )
A.质量数一定相同 B.核外电子数一定相同
C.中子数一定不同 D.电子层数可能不同
难度: 中等查看答案及解析
-
有关物质用途的叙述错误的是 ( )
A.氧炔焰:切割、焊接金属 B.用SO2漂白食品
C.液氮:冷冻物质 D.稀有气体:填充霓虹灯
难度: 中等查看答案及解析
-
下列各项中表达正确的是 ( )
A.F—的结构示意图:
B.乙炔的分子模型示意图:
C.NaCl的电子式:
D.乙酸的结构简式:C2H4O2
难度: 中等查看答案及解析
-
判断下列有关化学基本概念的依据正确的是 ( )
A.氧化还原反应:是否有电子转移
B.共价化合物:是否含有共价键
C.强弱电解质:电解质溶解度大小
D.金属晶体:晶体是否能够导电
难度: 中等查看答案及解析
-
以下描述错误的是( )
A.打开盛有浓盐酸的细口瓶,瓶口产生白雾
B.光照AgCl,有黑色固体颗粒产生
C.铁在氯气中燃烧发出褐色的烟,溶于水得浅绿色溶液
D.聚氯乙烯燃烧发出明亮而带黑烟的火焰,并产生刺激性气味
难度: 中等查看答案及解析
-
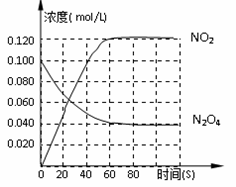
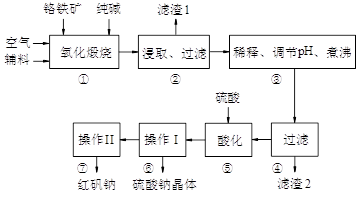
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右下图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。
根据以上信息和数据,下列说法正确的是 ( )
A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高
D.N4气体转变为N2将吸收热量
难度: 中等查看答案及解析
-
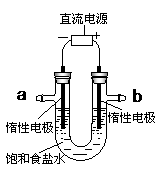
如右图,电解用粗盐(含Mg2+、Ca2+、SO42¯等杂质)配制的食盐水,以下说法正确的是( )
A.a是电解池的阳极
B.b电极上发生还原反应
C.a电极附近有白色沉淀出现
D.b电极上有无色气体产生
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2→2Fe3++2Cl-
B.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴加氢氧化钡至中性:H++SO
+Ba2++OH-→BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+→Fe3++3H2O
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.将氢氧化钠固体放在滤纸上称量
B.用10mL量筒量取8.58mL蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排饱和食盐水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁固体溶解在较浓盐酸中,再用水稀释到所需浓度
难度: 中等查看答案及解析
-
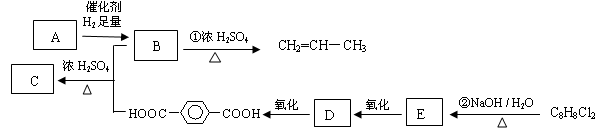
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示。
下列关于莽草酸的说法错误的是 ( )
A.能溶于水
B.能使酸性高锰酸钾溶液褪色
C.能发生酯化反应
D.遇FeCl3溶液呈紫色
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是 ( )
A.K3C60中既有离子键,又有极性键
B.1 molK3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
难度: 中等查看答案及解析
-
13.8g 63%的HNO3溶液密度为1.38g•cm-3和100mL 13.8 mol/L的HNO3溶液相比,正确的是( )
A.都应用棕色广口瓶存储
B.浓度不同的两种HNO3(aq)
C.溶液的体积不同但浓度相同
D.均可与Au反应而发生钝化现象
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.等物质的量的N2和CO所含分子数均为NA
B.1.7gH2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L辛烷所含分子数为0.1 NA
难度: 中等查看答案及解析
-
在pH=13的无色溶液中,可以大量共存的一组离子是 ( )
A.NH4+、NO3—、K+、SO42— B.CO32_、NO3—、HCO3—、Na+
C.Na+、ClO—、AlO2—、NO3— D.MnO4—、K+、Na+、SO42—
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g)+270kJ,下列说法正确的是( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.葡萄糖与新制的氢氧化铜悬浊液混合,加热,有红色沉淀生成
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的是( )
A.气体Y是SO2 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
难度: 中等查看答案及解析
-
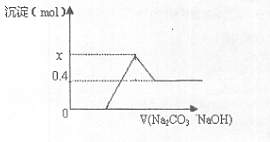
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是 ( )
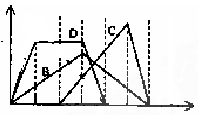
A.曲线A表示将足量的CO2不断通入KOH、KAlO2的混合溶液中,生成沉淀的物质的量与通入CO2体积的关系示意图
B.曲线B是向澄清石灰水中通入CO2至过量
C.曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.曲线D是向含有等物质的量的Ca(OH)2、KOH溶液中通入CO2至过量
难度: 中等查看答案及解析
-
下列各组溶液中,不用任何其他试剂就能鉴别的是( )
A.NaAlO2 KHCO3 NaCl NaHSO4 B.HCl NaOH K2SO4 NaHSO4
C.Na2SO4 H2SO4 AlCl3 BaCl2 D.NaOH FeCl3 MgCl2 K2SO4
难度: 中等查看答案及解析
-
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。
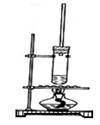
下列对实验叙述错误的是 ( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
难度: 中等查看答案及解析
-
常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL0.1000 mol·L-1CH3COOH溶液所得滴定曲线如右图.
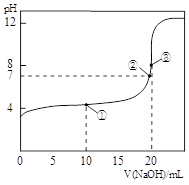
下列说法正确的是 ( )
A.点①所示溶液中:c(CH3COO—) +2 c(OH—) = c(CH3COOH) + 2c(H+)
B.点②所示溶液中:c(Na+) <c(CH3COO—) + c(CH3COOH)
C.点③所示溶液中:c(Na+) >c(OH—) >c(CH3COO—) > c(H+)
D.滴定过程中可能出现: c(CH3COOH) >c(H+) >c(CH3COO—) >c(Na+) >c(OH—)
难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。
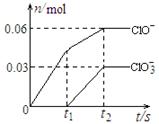
下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是4.94g
B.反应中转移电子的物质的量是0.21mol
C.氧化性ClO-<ClO3-
D.ClO3-的生成是由于温度升高引起的
难度: 中等查看答案及解析