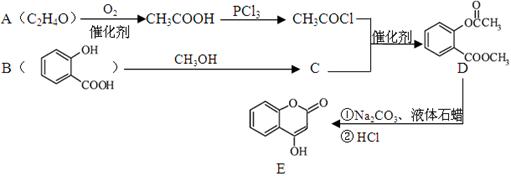
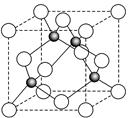
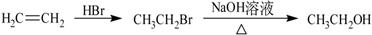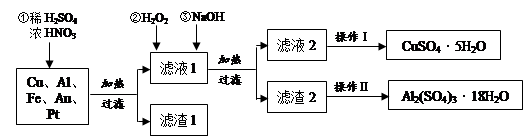-
随着社会的发展,人们日益重视环境问题,下列说法不正确的是
A.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2排放
C.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A.氯化氨的电子式:
B.S原子的结构示意图:
C.二氧化硅的分子式:SiO2 D.原子核内有10个中子的氧原子:
O
难度: 简单查看答案及解析
-
下列有关物质或应用正确的是
A.单质硅可用于制造光纤和太阳能电池
B.在常温下可用铝制容器贮藏运输浓硫酸
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性小于铁,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 简单查看答案及解析
-
下列各组溶液中,可能大量共存的离子有
A.加入Al粉后反应产生H2的溶液中:NH4+、Na+、SiO32-、HCO3-
B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2-
C.水电离产生的c(OH-)=1×11-11mol/L的溶液中:Al3+、SO42-、NO3-、Cl-
D.含有大量I—的溶液中:K+、Mg2+、ClO-、SO42-
难度: 简单查看答案及解析
-
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
A.放出碘的苯溶液 B.分离碘并回收苯 C.将海带灼烧 D.过滤含I-溶液
难度: 简单查看答案及解析
-
已知实验室中,可用Co2O3代替MnO2来制备氯气,反应前后存在的六种微粒分别是:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是
A.Cl2发生还原反应
B.氧化剂与还原剂的物质的量之比为1︰2
C.若反应中生成3molH2O,则转移电子2mol
D.理论上利用该反应可以将化学能转化为电能
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数值,下列叙述正确的是
A.1 molNa2O2与足量的水反应,转移的电子数为2NA
B.7.1 g Cl2完全参加反应,转移的电子数一定为0.1NA
C.电解饱和食盐水,生成1mol氢氧化钠,转移的电子数为2 NA
D.标准状况下,22.4L的CO2和O2组成的混合物中,含氧原子数为2NA
难度: 简单查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X形成的最高价氧化物对应的水化物的碱性强于Y。下列说法正确的是
A.原子半径大小为Z>Y>X>W
B.W与X形成的化合物中可能含有共价键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 简单查看答案及解析
-
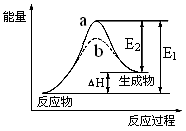
已知2SO2(g)+O2(g)
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
A.在2min内,v (SO2)="0.25" mol·L-1·min-1
B.若再充入0.1molSO3,达到平衡后SO3的质量分数会减小
C.在1min时,c(SO2)+c(SO3)="0.01" mol·L-1
D.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,平衡后反应放热小于0. 025a kJ
难度: 简单查看答案及解析
-
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
下列选项正确的是
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
B.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=+1734 kJ·mol-1
C.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l)ΔH=-x kJ·mol-1 x <574
D.常温常压下用2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol
难度: 简单查看答案及解析
-
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是
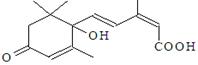
A.其分子式为C15H21O4
B.分子中只含有1个手性碳原子
C.既能发生加聚反应,又能发生缩聚反应
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
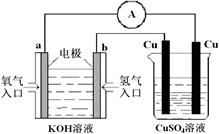
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A.放电时K+ 向负极移动
B.放电时负极区域的pH会增大
C.充电时锌极与外电源负极相连
D.充电时阳极反应为:Fe(OH)3-3e- + 5OH-="===" FeO42- + 4H2O
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2—+2H2O
B.金属钠与水反应: Na+H2O=Na++OH-+ H2↑
C.Ba(OH)2溶液中滴加少量NH4HCO3溶液:NH4++HCO3-+2OH-+Ba2+=NH3·H2O+H2O+BaCO3↓
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O
H2↑+Cl2↑+2OH-
难度: 简单查看答案及解析
-
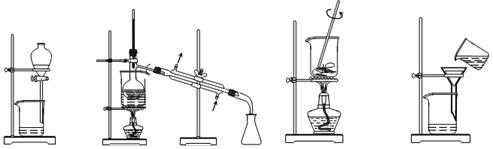
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
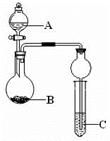
A.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝
B.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中产生白色沉淀
D.若A为浓硫酸,B为炭,C中盛有品红溶液,则C中溶液红色褪色
难度: 简单查看答案及解析
-
纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
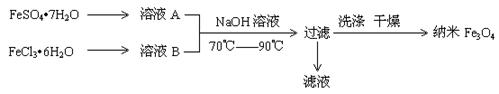
下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
难度: 简单查看答案及解析