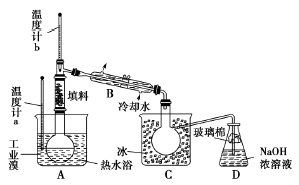
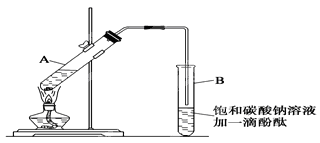
-
下列变化中,属于物理变化的是( )
①石油的分馏
②煤的干馏
③石油的裂化
④铝热反应
⑤由乙烯变为聚乙烯
⑥氧气转变为臭氧
⑦乙烯催熟果实
⑧苯遇溴水
⑨海水蒸馏法制取淡水
A.①②③④ B.①②⑤⑦ C.①⑧⑨ D.①②⑥⑨
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧.后者放出的热量多
B.由C (金刚石)→C (石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定
C.在l01KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g) + O2(g) =2H2O(l) △H=+285.8kJ/mol
D.稀溶液中:H+(aq)+ OH-(aq) =H2O(l)△H=-57.3kJ/mol 。若将含0.5moIH2SO4的浓溶液与含lmolNaOH的溶液混合,放出的热量大于57.3kJ
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为热能的是
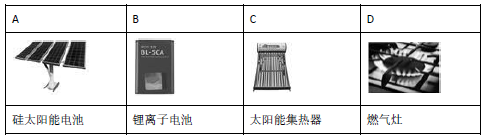
难度: 简单查看答案及解析
-
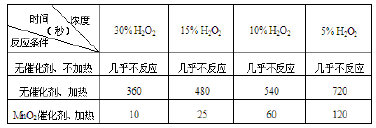
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )
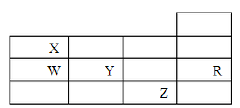
A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
难度: 中等查看答案及解析
-
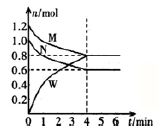
在一定温度下,可逆反应A (g) + 3B (g)
2C(g)达到平衡的标志是
A.C的生成速率与B的生成速率相等
B.单位时间生成nmoIA,同时生成3nmolB
C.A、B、C的体积分数不再变化
D.A 、B 、C 的分子数比为1:3:2
难度: 简单查看答案及解析
-
将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )
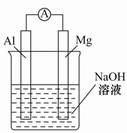
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
难度: 困难查看答案及解析
-
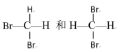
某有机物的结构如图所示,该有机物不可能具有的性质是( )
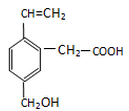
A.能跟NaOH溶液反应
B.能使酸性KMnO4溶液褪色
C.能发生酯化反应
D.能发生水解反应
难度: 中等查看答案及解析