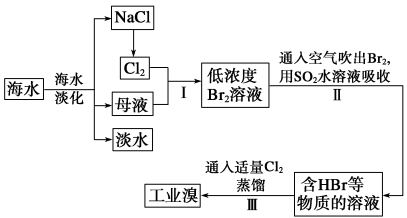
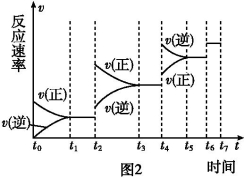
-
化学与生产、生活密切相关,下列说法正确的是
A.淀粉溶液、豆浆、碳素墨水均可发生丁达尔现象
B.明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用
C.火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质
D.鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯
难度: 简单查看答案及解析
-
分类法是学习和研究化学的一种常用的科学方法,下列分类合理的是
A.根据分散系的稳定性将其分为胶体、溶液和浊液
B.根据化合物在溶液中能否电离将其分为强电解质和弱电解质
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸和多元酸
D.根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
难度: 中等查看答案及解析
-
进行化学实验时应强化安全意识,下列做法正确的是
A. 金属钠着火时使用泡沫灭火器灭火
B. 用试管加热碳酸氢钠固体时使试管口竖直向上
C. 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D. 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
难度: 简单查看答案及解析
-
实验室中以下物质的贮存方法不正确的是
A. 少量金属钠保存在煤油中
B. 试剂瓶中的液溴可用水封存,防止溴挥发
C. 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
D. 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
难度: 简单查看答案及解析
-
下列各组离子在溶液中能够大量共存的是
A.NH4+、NO3-、Na+、SO42-
B.H+、Fe2+、Na+、NO3-
C.Ba2+、K+、Al3+、HCO3-
D.NH4+、Li+、OH-、SO42-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol•L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
B.用烧碱溶液吸收氯气:Cl2 + 2OH-= Cl- + ClO-+ H2O
C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4+ + OH-= NH3·H2O
D.FeBr2溶液中通入少量Cl2:2Fe2+ + 2Br- + Cl2 = 2Fe3+ + Br2 + 2Cl-
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是
选项
目的
分离方法
原理
A
使用CCl4提取碘水中的碘
萃取、分液
碘在CCl4中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去淀粉胶体中的NaCl
过滤
淀粉胶体不能透过滤纸
D
分离氯化钠和氯化铵
升华
氯化铵易升华
难度: 中等查看答案及解析
-
对下列装置图的叙述正确的是

A.装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体
B.装置②可用于铜和稀硝酸制取并收集少量NO
C.装置③可用于证明铁生锈氧气参与反应
D.苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法中不正确的是
A.KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为5NA
B.标准状况下,5.6 L氧气中含有O的总数为0.5NA
C.25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA
D.20 g重水(D2O)中所含电子总数为8NA
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42-
B.在c(H+)/c(OH-)=10-12的溶液中:K+、Ba2+、Cl-、ClO-
C.水电离产生的c(H+)=10-13mol•L-1 的溶液中:Na+、Cl-、NO3-、CH3COO-
D.pH=0的溶液中:Na+、NO3-、S2-、Cl-
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融)
Mg + Cl2↑[
B.向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+H2O+CO2 == 2HClO +CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) == CaCO3(s) + Na2SO4(aq)
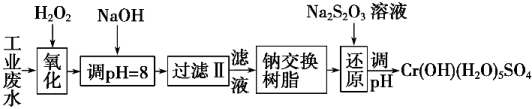
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
难度: 中等查看答案及解析
-
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
选项
目的
原理
A
除去Na2CO3固体中的NaHCO3
置于坩埚中加热至恒重
B
除去NaCl中少量KNO3
将混合物制成热饱和溶液,冷却结晶,过滤
C
除去CO2中的HCl气体
通过NaHCO3溶液,然后干燥
D
除去C2H5Br中的Br2
加入足量的Na2SO3溶液,充分振荡,分液
难度: 中等查看答案及解析
-
工业废气的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3→N2+H2O。有关此反应,下列说法中错误的是
A.N2既是氧化产物又是还原产物
B.反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O
C.当x=1时,每生成2.5mol N2,被氧化的气体有3mol
D.当x=2时,有1mol气体被还原时,转移的电子为4mol
难度: 中等查看答案及解析