-
下列叙述正确的是( )
A.某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液PH<7
C.常温下,1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0
D.若1mLPH=1盐酸与100mLNaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.v正(X)=v逆(Z)
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2molZ难度: 中等查看答案及解析
-
可逆反应3A(g)⇌3B(?)+C(?);正反应吸热,随着温度的升高,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B不一定是气体
D.B和C可能都是气体难度: 中等查看答案及解析
-
NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是( )
A.使用适当的催化剂不改变反应速率
B.降低压强能提高反应速率
C.升高温度能提高反应速率
D.改变压强对反应速率无影响难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al难度: 中等查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
A.
B.26M3+
C.
D.难度: 中等查看答案及解析
-
下列事实中,不能用平衡移动原理来解释的是( )
A.工业上由氢气和氮气合成氨是在较高温度下进行的
B.加压后二氧化碳在水中的溶解度增大
C.盛有二氧化氮气体的烧瓶,浸入热水浴后颜色变深
D.打开冰镇啤酒的瓶盖时,有大量泡沫溢出难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)=mol/L
C.混合溶液的pH=7
D.混合溶液中,c(H+)+c(B-)=c(OH-)+c(A-)难度: 中等查看答案及解析
-
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1溶液中:NH4+、K+、ClO-、Cl-
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D.在c(H+)=1.0×10-13mol/L的溶液中:Na+、S2-、AlO2-、SO42-难度: 中等查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡时,测得A、B、C物质的量之比为2:2:1.若保持温度不变,以2:2:1的物质的量之比再充入A、B、C,下列判断正确的是( )
A.平衡向逆反应方向移动
B.平衡不会发生移动
C.C的质量分数增大
D.C的质量分数可能减小难度: 中等查看答案及解析
-
下列离子浓度关系正确的是( )
A.0.1mol•L-1的NH4Cl溶液中c(NH4+)=c(Cl-)
B.同为0.1mol•L-1的CH3COOH和氢氧化钠溶液等体积混合后,c(OH-)=c(H+)
C.向NH4Cl溶液中滴加氨水至PH=7时,c(NH4+)<c(Cl-)
D.PH=3的H2SO4和PH=11的NaOH溶液等体积混合后,溶液中c(OH-)=c(H+)难度: 中等查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)⇌CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表:
上述四种情况达到平衡后,n(CO)的大小顺序是( )CO2 H2 CO H2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol
A.丁>乙>丙=甲
B.乙>丁>甲>丙
C.乙=丁>丙=甲
D.丁>丙>乙>甲难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析
-
常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如右图.下列说法正确的是( )
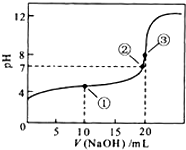
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.若pH=2的HA(aq)和pH=12的MOH(aq)混合溶液中存在c(H+)+c(M+)=c(OH-)+c(A-),则HA与MOH一定是等体积混合
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol•L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)⇌
(aq),某I2、KI混合溶液中,
的物质的量浓度c(
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
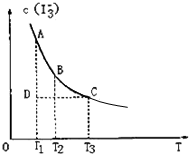
A.反应I2(aq)+I-(aq)⇌(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,可能有υ正>υ逆
D.状态A与状态B相比,状态A的c(I2)大难度: 中等查看答案及解析