-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+
B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+
D.只有Fe2+难度: 中等查看答案及解析
-
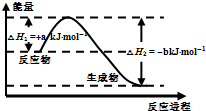
煤化工生产中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡常数随温度的变化如表:
则下列说法错误的是( )温度/℃ 400 500 830 1000 平衡常数K 10 9 1 0.6
A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50%
B.上述正向反应是放热反应
C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动
D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小难度: 中等查看答案及解析
-
下列物质的组成中一定含有氧元素的是( )
①氧化物 ②酸 ③碱 ④盐 ⑤有机物.
A.①②③④⑤
B.②③④
C.①③
D.①⑤难度: 中等查看答案及解析
-
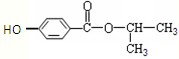
下列关于有机物的说法中,不正确的是( )
A.与
互为同分异构体
B.新制氢氧化铜悬浊液可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液
C.植物油与乙醇可以混溶
D.医用75%的酒精溶液作消毒剂,原理是医用酒精能使蛋白质变性难度: 中等查看答案及解析
-
下列有关实验操作正确的是( )
A.用托盘天平称取10.50g的干燥的NaC1固体
B.可用25mL碱式滴定管量取20.00mL KMnO4溶液
C.配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,及时搅拌和冷却
D.测溶液的pH需先用蒸馏水润湿pH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,并与标准比色卡对照难度: 中等查看答案及解析
-
对于下列各种溶液中,微粒的物质的量浓度关系表述正确的是( )
A.在25℃100mLNH4Cl溶液中:c (Cl-)=c (NH4+)+c (NH3∙H2O)
B.0.1mol•L-1的NaHSO3溶液中:c (Na+)=c (HSO3-)+c (H2SO3)+2c (SO32-)
C.将0.2mol•L-1NaA溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c (Na+)+c (H+)=c (A-)+c (Cl-)
D.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等难度: 中等查看答案及解析
-
常见镍氢电池的某电极材料是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5+6Ni(OH)2
LaNi5H6+6NiO (OH),下列说法正确的是( )
A.放电时,储氢合金作正极
B.放电时,负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O
C.充电时,阳极周围c(OH-)增大
D.充电时,储氢合金作阳极难度: 中等查看答案及解析