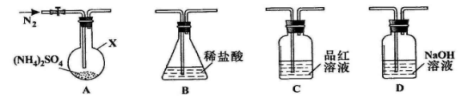
-
下列物质在生活中应用时,起还原作用的是
A.明矾作净水剂
B.甘油作护肤保湿剂
C.漂粉精作消毒剂
D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
下列有关CuSO4溶液的叙述正确的是
A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
B.通入CO2气体产生蓝色沉淀
C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓
D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
难度: 中等查看答案及解析
-
下列操作或装置能达到实验目的的是
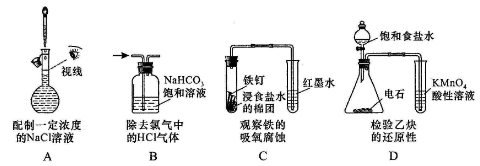
难度: 困难查看答案及解析
-
用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
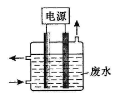
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
难度: 极难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含σ键数目为0.7NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.
<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
难度: 困难查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 困难查看答案及解析