-
下列说法中,错误的是
A.人类目前直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
难度: 简单查看答案及解析
-
我国稀土资源丰富。下列有关稀土元素
Sm与
Sm的说法正确的是
A.
Sm与
Sm互为同位素
B.
Sm与
Sm的质量数相同
C.
Sm与
Sm是同一种核素
D.
Sm与
Sm的核外电子数和中子数均为62
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是
A.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
B.甲醇燃料电池可把化学能转化为电能
C.锂电池是一种二次电池
D.锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层8电子结构的是
A.六氟化硫 B.光气(COCl2) C.二氟化氙 D.三氟化硼
难度: 简单查看答案及解析
-
同一主族的两种元素的原子序数之差不可能是
A.16 B.26 C.36 D.46
难度: 中等查看答案及解析
-
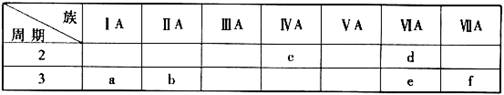 下表是元素周期表的一部分,有关说法正确的是
下表是元素周期表的一部分,有关说法正确的是A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
难度: 中等查看答案及解析
-
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相
邻,X的核电荷数是Y核外电子数的一半,Y和M可形成M2Y。下列说法正确的是
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2和M2Y都是含有极性键的共价化合物
D.Z元素的最高价氧化物的水化物的化学式为HZO4
难度: 中等查看答案及解析
-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 中等查看答案及解析
-
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
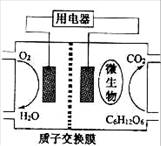 关于该电池的叙述正确的是
关于该电池的叙述正确的是A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体
难度: 中等查看答案及解析
-
由ⅢA族元素与VIA族元素组成的阴离子,如下图所示:

由此可知三种离子的电荷数X、Y、Z分别为
A.2,3,4 B.4,3,2 C.4,2,3 D.3,2,4
难度: 困难查看答案及解析
-
下列事实与氢键有关的是
A.水加热到很高温度都难以分解
B.水结冰体积膨胀,密度减小
C.CH4、SiH4、GeH4、SnH4熔点随分子量增大而升高
D.HF、HCl、HBr、HI热稳定性逐渐减弱
难度: 中等查看答案及解析
-
下列说法中正确的是
A.含有共价键的分子一定是共价分子
B.只含有共价键的物质一定是共价化合物
C.离子化合物中可能含有极性共价键或非极性共价键
D.氦分子中含有共价键
难度: 中等查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+< Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
难度: 中等查看答案及解析
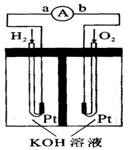 (1) 氢氧燃料电池的能量转化主要形式是
(1) 氢氧燃料电池的能量转化主要形式是