-
下列实验操作中,对应的实验现象以及实验结论都正确且两者具有因果关系的是
实验操作
实验现象
实验结论
A
向碳酸钠溶液中先滴入酚酞,再滴加稀盐酸
溶液先变红,后溶液红色变浅直至消失
非金属性:Cl>C
B
将氯化铝溶液蒸干
析出白色固体
白色固体是氯化铝
C
取少量某无色溶液,先滴加氯水,再加入少量苯,振荡、静置
溶液分层,下层呈紫红色
原无色溶液中一定有I-
D
将铜片放入浓硫酸中,加热
产生大量气体,将反应后混合物倒入水中得蓝色溶液
浓硫酸具有强氧化性和酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期元素,X2- 和Y+的核外电子排布相同;Z电子层数与最外层电子数相等,W 原子是同周期主族元素中半径最小的。下列说法正确的是
A. 简单离子半径:Z>W>X>Y
B. X的氢化物中不可能含有非极性键
C. 由X 与Y两种元素组成的物质可能有漂白性
D. 元素Y、Z 的氧化物的水化物之间相互反应生成的盐溶液呈中性
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法中正确的是
A. 可将大量的硫磺和甲基苯酚添加到肥皂中做消毒剂
B. 可以通过煤的干馏得到苯、二甲苯等化工原料粗品
C. 神州十一号航天员的航天服由碳化硅陶瓷和碳纤维复合制成,它是一种新型有机复合材料
D. 乙酸乙酯在碱性条件下的水解反应又称皂化反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 23 g钠在氧气中充分燃烧,转移的电子数为0.5 NA
B. 将1mol Cl2通入到水中,则有N(HClO)+N(Cl-)=2 NA
C. 25℃,pH=7的NH4Cl和NH3·H2O的混合溶液中,含OH-的数目为10-7 NA
D. 4.2 g乙烯和丙烯混合气体中含有的极性键数目为0.6 NA
难度: 困难查看答案及解析
-
有机化合物的结构可用键线表示,如CH2=CHCH2Br可表示为
,则有机物
的六氯代物有
A. 4种 B. 8种 C. 12种 D. 16种
难度: 中等查看答案及解析
-
电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是

A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
难度: 中等查看答案及解析
-
若用AG表示溶液的酸度,其表达式为:
。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
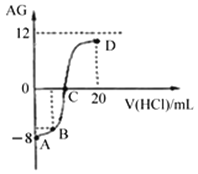
A. 该滴定过程可选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 溶液中由水电离的c(H+):C点>D点
D. 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+c(H+)= c(MOH)+ c(OH-)
难度: 中等查看答案及解析

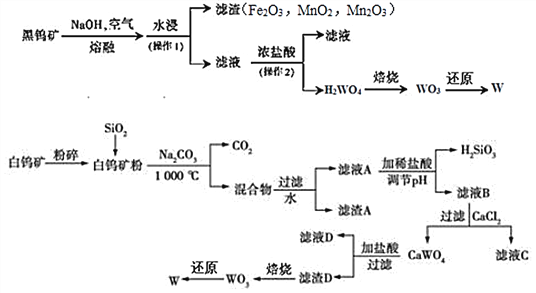

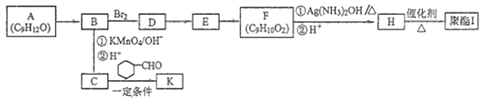
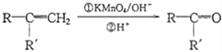 +CO2
+CO2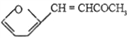 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(