-
“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列叙述中不正确的是




A.可用灼烧法鉴别毛笔笔头是否含蛋白质
B.用墨写字可长久不褪色
C.主要成分是纤维素
D.用工具打磨石材的过程是化学变化
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
4种短周期元素在周期表中的位置如下图,X原子最外层有6个电子。下列说法不正确的是
W
X
Y
Z
A. 离子半径:X2−< Y2−
B. 非金属性:W< X
C. 还原性:Y2−< Z−
D. 酸性:H2YO4< HZO4
难度: 中等查看答案及解析
-
下列说法正确的是
A. 麦芽糖的水解产物不能发生银镜反应
B. 油脂在酸性或碱性条件下均可发生水解反应,最终产物不相同
C. 蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,再加水不再溶解
D. 用甘氨酸
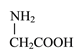 和丙氨酸
和丙氨酸 缩合最多可形成3种二肽
缩合最多可形成3种二肽难度: 中等查看答案及解析
-
X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X
Y
Z
箭头上所标数字的反应条件
A.
NO
NO2
HNO3
①常温遇氧气
B.
Cl2
NaClO
HClO
②通入CO2
C.
Na2O2
NaOH
NaCl
③加入H2O2
D.
Al2O3
NaAlO2
Al(OH)3
④加NaOH溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列关于物质结构和元素性质说法正确的是
A. 非金属元素之间形成的化合物一定是共价化合物
B. 乙醇可与水以任意比例混溶,是因为与水形成氢键
C. IA族与VIIA族元素原子之间形成的化学键是离子键
D. 同主族元素的简单阴离子还原性越强,水解程度越大
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 1.0 mol/L Na2CO3溶液中:c(Na+) = 2[c(CO32-)+c(HCO3-)+c(H2CO3) ]
B. 常温下把等物质的量浓度的盐酸和NaOH溶液等体积混合后,其溶液的pH恰好等于7
C. 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(OH-) = c(H+) + c(Na+)
D. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+) > c(HX) > c(X-) > c(H+) > c(OH-)
难度: 中等查看答案及解析
-
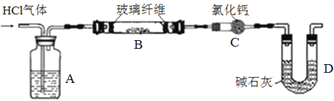
某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1
实验2
实验3
装置
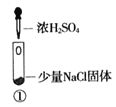
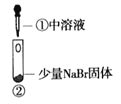

现象
试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟
溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝
溶液变深紫色;经检验溶液含单质碘
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br- >Cl-
C. 根据实验3判断还原性:I- >Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
难度: 中等查看答案及解析
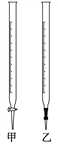
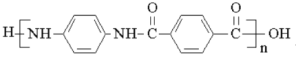 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: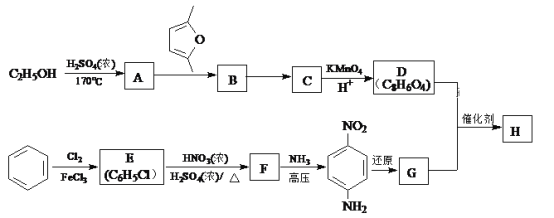
 。
。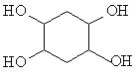 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。