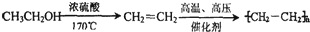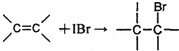-
下列有关说法不正确的是( )
A.ClO2可以做杀菌消毒剂来进行环境杀菌消毒
B.食品保鲜膜、一次性食品袋的主要成分是聚乙烯
C.高浓度的放射性碘-131和放射性氡-219在被吸入人体后会对健康造成恶劣影响
D.绿色化学的核心是应用化学原理对环境污染进行治理难度: 中等查看答案及解析
-
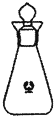
下列化学用语表示正确的是( )
A.HClO的电子式为
B.16O2与18O2互为同分异构体
C.饱和醇的通式CnH2n+2O
D.表示四氯化碳分子的比例模型
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.22.4L的CO气体与lmolN2所含的电子数均为NA
B.56g铁粉在1molCl2中充分反应失去电子数为2NA
C.0.1mol/LNa2CO3溶液中CO32-和HCO3-总数为0.1NA
D.68g的天然橡胶(聚异戊二烯)含有π键的数目为2NA难度: 中等查看答案及解析
-
下列有关物质的性质或应用说法正确的是( )
A.糖类、油脂、蛋白质在一定条件下均可以水解
B.医疗上可用BaCO3作X射线透视肠胃的内服药剂
C.从海水中得到氯化镁晶体,电解氯化镁晶体可获得金属Mg
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是( )
A.遇苯酚显紫色的溶液中:I-、AlO2-、SCN-、Mg2+
B.使pH试纸变为蓝色的溶液中:Na+、C1-、S2-、ClO-
C.c(HCO3-)=0.1mol/L的溶液中:NH4+、K+、SO32-、Br-
D.常温下水电离产生的c(H+)、c(OH-)满足c(H+)•c(OH-)=10-24:Mg2+、NH4+、SO42-、NO3-难度: 中等查看答案及解析
-
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质.它的化学式Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是( )
A.青石棉的化学组成用氧化物的形式可表示为:Na2O•5FeO•8SiO2•H2O
B.该反应中氧化产物与还原产物的物质的量之比为3:1
C.青石棉是一种易燃品,且易溶于水
D.适量Na2Fe5Si8O22(OH)2能完全溶于足量硝酸中,得到澄清透明溶液难度: 中等查看答案及解析
-
下列实验原理及装置合理的是( )
A.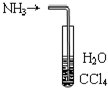 吸收NH3防止倒吸
吸收NH3防止倒吸
B.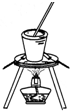 从食盐水中提取NaCl
从食盐水中提取NaCl
C.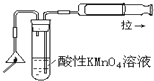 检验火柴头燃烧产生的SO2
检验火柴头燃烧产生的SO2
D.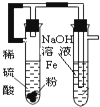 制备Fe(OH)2
制备Fe(OH)2 难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
编号 甲 乙 丙 丁 ① Cu CuO CuSO4 Cu(NO3)2 ② Na2CO3 NaOH NaHCO3 CO2 ③ N2 NH3 NO NO2 ④ CH3CH2Br C2H5OH CH2=CH2 CH3CH3 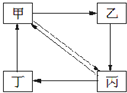
A.①②③
B.①②③④
C.①③④
D.②③④难度: 中等查看答案及解析
-
灰黄霉素是一种抗真菌药,可由甲和乙在三级丁醇体系中合成,反应式如下:
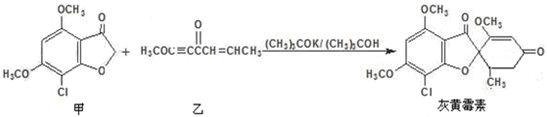
下列说法正确的是( )
A.乙的一种同分异构体是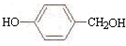
B.甲和乙的反应属于加成反应
C.乙物质分子中所有的碳原子不可能在同一平面上
D.1mol灰黄霉素最多能与4molH2发生加成反应难度: 中等查看答案及解析
-
下列方程式正确的是( )
A.热化学方程式C2H2(g)+O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
B.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.在稀氨水中通入少量CO2:2NH3•H2O+CO2=2NHH4++CO32-+H2O
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-CH3COO-+NH4++3NH3+2Ag↓+H2O
难度: 中等查看答案及解析
-
由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎.下图是氢氧燃料电池驱动LED发光的装置.下列有关叙述正确的是( )
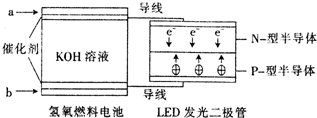
A.a处通入氧气,b处通入氢气
B.该装置中只涉及两种形式的能量转化
C.电池正极电极反应式为O2+2H2O+4e-═4OH-
D.P一型半导体连接的是电池负极难度: 中等查看答案及解析
-
下列溶液中有关粒子的物质的量浓度关系正确的是( )
A.25℃时,pH=4的HCl溶液与pH=4的醋酸溶液中:c(Cl-)=c(CH3COO-)
B.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
C.pH=8的0.1mol/L的NaHB溶液中:c(HB-)>c(H+)>c(B2-)>c(H2B)
D.1mol•L-1的Na2S溶液中:c(OH-)=c(HS-)+c(H2S)+c(H+)难度: 中等查看答案及解析
-
A、B、C、D、E是原子序数逐渐增大的5种短周期元素,A与B组成的化合物BA4是具有温室效应的气体之一,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.下列说法不正确的是( )
A.B在元素周期表中的位置是第二周期IVA族
B.工业合成CA3的反应是放热反应,增大压强能加快反应速率,又能提高原料转化率
C.气态氢化物的沸点:C>D
D.C和E组成的一种离子化合物,能与水反应生成两种碱难度: 中等查看答案及解析
-
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)2Z(g)△H<0
保持温度不变,测得平衡时的有关数据如下:
下列说法正确的是( )恒容容器甲 恒压容器乙 X的物质的量(mol) n1 n2 Z的体积分数 φ1 φ2 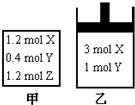
A.平衡时容器乙的容积一定比反应前小
B.n2>n1
C.平衡时容器甲的压强一定比反应前小
D.φ2>φ1难度: 中等查看答案及解析
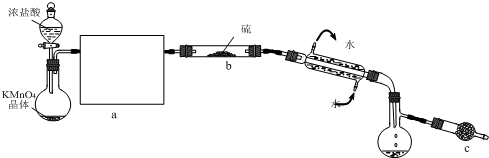
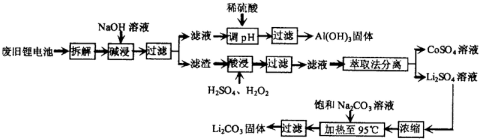
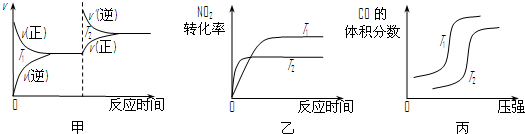
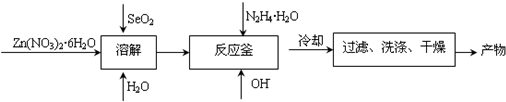
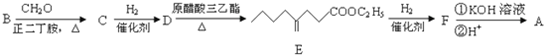

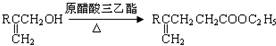
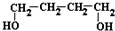 到
到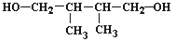 的合成路线(用流程图表示,并注明反应条件)______.
的合成路线(用流程图表示,并注明反应条件)______.