-
下列关于化学反应限度的说法中正确的是
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
难度: 简单查看答案及解析
-
据科学家预测,月球的土壤中吸附着数百万吨的
,每百吨
核聚变所释放的能量相当于目前人类一年消耗的总能量。在地球上,氦元素主要以
的形式存在。下列说法正确的是
A.
原子核内含有4个质子
B.
和
互为同位素
C.
原子核内含有3个中子
D.
最外层电子数为2,具有较强金属性
难度: 简单查看答案及解析
-
某主族元素R的原子的电子式可表示为:
该元素组成的以下物质,其化学式肯定错误的是
A.最高价氧化物化学式为R2O5
B.含氧酸分子式为 HRO3
C.含氧酸分子式为H3RO4
D.气态氢化物分子式为RH5
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为热能的是




A.硅太阳能电池 B.锂离子电池 C.太阳能集热器 D.燃气灶
难度: 简单查看答案及解析
-
某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
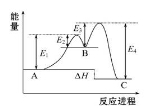
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应的ΔH=E1-E2
难度: 简单查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
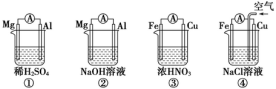
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为:2H2O+2e-= 2OH-+H2↑
C.③中Fe作负极,电极反应式为Fe-2e-= Fe2+
D.④中Cu作正极,电极反应式为2H++2e-= H2↑
难度: 中等查看答案及解析
-
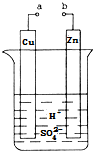
已知反应Cu(s) + 2Ag+ (aq) = Cu2+(aq) + 2Ag (s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是
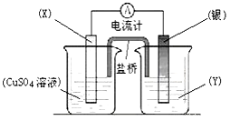
A.银电极质量逐渐减小,Y溶液中c(Ag+)增大
B.实验过程中取出盐桥,原电池仍继续工作
C.电极X是正极,其电极反应为Cu-2e- = Cu2+
D.当X电极质量减少0.64 g时,外电路中有0.02 mol电子转移
难度: 中等查看答案及解析
-
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是
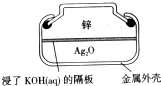
A.Zn作负极
B.电子经外电路流向Ag2O极
C.K+向Zn极移动
D.正极反应:Ag2O+H2O+2e-=2Ag+2OH-
难度: 中等查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
一定条件下,分别对反应C(s)+CO2(g)
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
A.①②③④ B.①③④ C.①② D.①③
难度: 中等查看答案及解析
-
对于A2+3B2 = 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.
(A2)=0.4 mol·L-1·s-1 B.
(B2)=0.8 mol·L-1·s-1
C.
(C)=0.6 mol·L-1·s-1 D.
(D)=0.6 mol·L-1·min-1
难度: 中等查看答案及解析
-
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
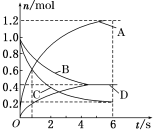
A.该反应的化学方程式为3B+4D
6A+2C
B.反应进行到1 s时,
=
C.反应进行到6s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6s时,各物质的反应速率相等
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl=NH3↑+ HCl↑ B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
下列热化学方程式正确的是
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+
O2(g)
H2O(g) ΔH=-242 kJ/mol
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ/mol
难度: 中等查看答案及解析
-
可逆反应2NO2
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变
A.①③⑤ B.①④⑤ C.①③④⑤ D.①②③④⑤
难度: 中等查看答案及解析