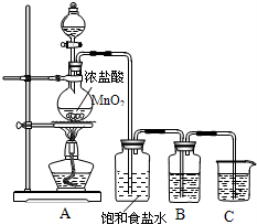
-
据最新报道:用10B合
成的10B20分子有非常好的抗癌作用。下列说法正确的是
A. 10B的质子数是10
B.10B的中子数与核外电子数不同
C.10B20是一种新合成的化合物
D.10B20具有较强的化学活性
难度: 简单查看答案及解析
-
下列说法中正确的是
A.通常元素的化合价与其原子的质量数有密切的关系
B.已知铱的一种核素是19177Ir,则其核内的中子数是114
C.146C和177N的质量数相同,但质子数不同,所以互称为同位素
D.钾的原子结构示意图为
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,
下列推断正确的是
A.35Cl与37 Cl与得电子能力相同
B.核外电子排布相同的微粒化学性质也相同
C.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 中等查看答案及解析
-
微量元素硒(Se)对人体有保健作用,含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强
B.氢化物比HBr稳定
C.原子序数为34
D.最高价氧化物的水化物显碱性
难度: 中等查看答案及解析
-
下
列各组中属于同位素关系的是
A.
与
B.T2O与H2O
C.
与
D.金刚石与石墨
难度: 中等查看答案及解析
-
下列粒子半径之比小于1的是
A.r (Ca)/ r (Mg) B.r (Cl-)/ r (Al3+)
C.r (Na)/ r (Mg) D.r (Na+)/ r (F-)
难度: 中等查看答案及解析
-
下列电子式书写正确的是
A.
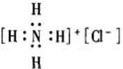 B.
B. 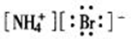
C.
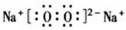 D.
D. 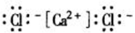
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数:c>b B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
难度: 中等查看答案及解析
-
下列变
化中,不需要破坏化学键的是
A.氯化氢溶于水 B.碘升华
C.加热氯酸钾使其分解 D.氧化钠熔化
难度: 中等查看答案及解析
-
下列物质中不含非极性共价键的是:①Na2O2 ②CCl4 ③O2 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2
A.①②③④ B.④⑤⑥ C.②④⑥ D.②③⑤ 、
难度: 中等查看答案及解析
-
下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl
D.非金属性:F>O>S
难度: 中等查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的
是
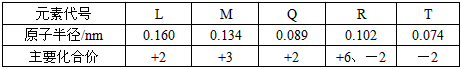
A.L2+与R2-的核外电子数相等
B.L与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.L和Q金属性:Q<L
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是
Y
Z
X
W
A.原子半径:X<Y<Z
B.最高价氧化物的水化物的酸性:Y<W
C.原子序数:X>W>Z>Y
D.Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
A.单质的沸点:W>Y
B.阴离子的还原性:Y>X
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
某元素的一种同位素X原子的质量数为A,含N个中子,它与1 H原子组成HmX分子, 在ag HmX分子中含质子的物质的量是
A.
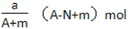 B.
B. 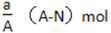
C.
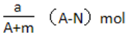 D.
D. 
难度: 困难查看答案及解析
-
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是
+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是
A.NaH的电子式为Na+[:H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,水作氧化剂。
难度: 困难查看答案及解析