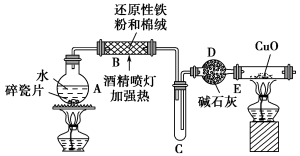
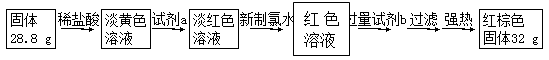
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
难度: 简单查看答案及解析
-
钠在空气中发生变化的过程是
A.Na→Na2O2→NaOH→Na2CO3·10H2O→Na2CO3
B.Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
C.Na→Na2O2→NaOH→Na2CO3→NaHCO3
D.Na→Na2O→NaOH→Na2CO3→NaHCO3
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤ NaAlO2
A.③④ B.②③④ C.①②③④ D.全部
难度: 中等查看答案及解析
-
下列物质能通过化合反应直接制得的是
①Na2O2 ②NaHCO3 ③Al(OH)3 ④FeCl2 ⑤Fe(OH)3
A.只有①②③ B. 只有①②④⑤
C. 只有①②④ D. 全部
难度: 简单查看答案及解析
-
下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是
A.Na+、K+、Cl-、CO32-
B.Cu2+、Na+、SO42-、NO3-
C.Ba2+、K+、Cl-、SO42-
D.K+、Na+、HCO3-、CO32-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.铁和盐酸反应 2Fe+6H+ = 2Fe3++3H2↑
B.小苏打溶液与少量澄清石灰水混合:
Ca2++OH-+HCO3-=CaCO3↓+H2O
C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- ══ Al(OH)3↓
D.Na2CO3溶液中通入少量CO2:CO32-+ CO2+ H2O=2HCO3-
难度: 困难查看答案及解析
-
下列有关含硅物质的说法正确的是
A.二氧化硅是酸性氧化物,它不溶于任何酸
B.高纯度的硅单质广泛用于制作光导纤维
C.二氧化碳通入水玻璃可以制得硅酸
D.水泥、玻璃、水晶饰物都是硅酸盐制品
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
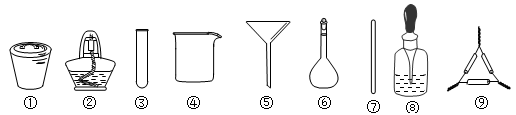
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧
难度: 简单查看答案及解析
-
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2
2Cu+SO2下列说法正确的是
A.该反应中Cu2S只是还原剂
B.每生产1molCu需转移2mol电子
C.该反应中SO2既是氧化产物又是还原产物
D.若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L
难度: 简单查看答案及解析
-
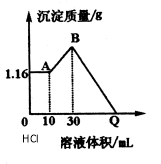
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是
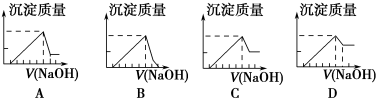
难度: 中等查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
A.Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.Na2O2中阴、阳离子的个数比为1∶1
C.Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol
D.Na2O2的漂白原理与活性炭的漂白原理相同
难度: 中等查看答案及解析
-
下列各组物质只用胶头滴管和试管就能鉴别的是
A.KOH溶液与AlCl3溶液 B.AlCl3溶液与氨水
C.NaAlO2溶液与盐酸 D.NaHCO3溶液与盐酸
难度: 中等查看答案及解析
-
向下列液体中滴加稀硫酸,开始时生成沉淀,继续滴加稀H2SO4沉淀又溶解的是
A.Na2CO3溶液 B.BaCl2溶液 C.NaAlO2溶液 D.Fe(OH)3胶体
难度: 中等查看答案及解析
-
将一块金属钠分别投入到下列物质的溶液中,有气体放出且溶液质量减轻的是
A.CuSO4 B.HCl C.BaCl2 D.FeCl3
难度: 中等查看答案及解析
-
有两种金属组成的混合物粉末15g与足量的稀盐酸反应,生成11.2L(标准状况下)H2,则该混合物的组成不可能是
A.Fe、Zn B.Al、Cu C.Al、Na D.Al、Fe
难度: 中等查看答案及解析
-
将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是
A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+ D.Cu、Fe2+
难度: 中等查看答案及解析
-
某无色透明溶液可能含有下列离子中的几种:Mg2+、Fe3+、Ba2+、H+、
SO42—、HCO3— 、OH—,在其中加入金属铁,发生反应放出H2,试判断上述离子中一定不能大量存在于此溶液中的有
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是
A.(m-16)g B.(m+16)g C.(m-32)g D.16 g
难度: 中等查看答案及解析
-
甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为
A.甲=乙 B.甲>乙 C.甲<乙 D.无法确定
难度: 困难查看答案及解析
-
(易混易错题组)
下列有关Na2CO3和NaHCO3的性质,叙述错误的是
A.Na2CO3比NaHCO3更易溶于水
B.NaHCO3比Na2CO3热稳定性更强
C.同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈
D.用澄清的石灰水可以鉴别Na2CO3和NaHCO3溶液
E.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3晶体析出
F.分别向等浓度的Na2CO3和NaHCO3溶液中滴加酚酞,前者红色更深
G.Na2CO3和NaHCO3的焰色反应现象均为黄色
难度: 中等查看答案及解析