-
化学与环境密切相关,下列说法正确的是
A.CO2属于大气污染物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大雾是一种胶体,能发生丁达尔效应
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为8的N原子:
B.离子结构示意图:
只能表示
C.碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3-
D.作为相对原子质量标准的碳原子:
难度: 简单查看答案及解析
-
下列气体通入蒸馏水中,可生成两种酸的是
A.Cl2 B.CO2 C.SO2 D.NH3
难度: 简单查看答案及解析
-
有关物质与反应分类的下列说法中,正确的是
A.硅酸钠是钠盐,也是硅酸盐
B.碳酸钠使无色酚酞试液变红,属于碱
C.CO2溶于水能导电,属电解质
D.CO还原氧化铁获得铁,属于置换反应
难度: 简单查看答案及解析
-
下列用品的有效成分及用途对应错误的是
A B C D
用品

有效成分 NaCl Na2CO3 Al(OH)3 Ca(ClO)2
用途 做调味品 做发酵粉 做抗酸药 做消毒剂
难度: 简单查看答案及解析
-
下列单质或化合物性质的描述正确的是
A.NaHCO3的热稳定性大于Na2CO3
B.SiO2与酸、碱均不反应
C.常温下,NO易与空气中氧气发生化合反应
D.氯化氢与氨气相遇,有大量的白雾生成
难度: 简单查看答案及解析
-
下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂 B.工业和生活中常用HF来刻蚀玻璃
C.工业上利用合成氨实现人工固氮 D.工业上电解熔融状态Al2O3制备Al
难度: 简单查看答案及解析
-
下列做法正确的是
A.金属钠着火时,用大量水进行灭火
B.铝制餐具可代替铁制餐具长时间存放酸性、碱性食物
C.在50mL量筒中配制0.1mol·L-1碳酸钠溶液
D.易燃、易爆药品与有强氧化性的物质要分开放置并远离火源
难度: 简单查看答案及解析
-
某溶液中存在大量的NH4+、SO42-、Cl-,该溶液中还可能大量存在的离子是
A.Ba2+ B.Na+ C.OH- D.Ag+
难度: 简单查看答案及解析
-
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
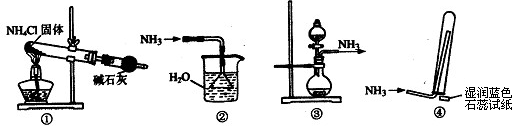
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
难度: 简单查看答案及解析
-
Na2S2O3可用作纺织工业氯气漂白布匹后的“脱氯剂”:4C12+ Na2S2O3+5 H2O=2NaCl+2H2SO4+6 HCl,有关该反应的叙述正确的是
A.C12是氧化剂 B.H2SO4是氧化产物
C.反应中S元素的价态降低 D.反应中H2O被氧化
难度: 简单查看答案及解析
-
设NA 为阿伏伽德罗常数的数值,下列说法正确的是
A.1mol NaCl中,Na+的核外电子总数为10NA
B.1molFe与过量的稀HNO3反应,转移2NA个电子
C.0.1mol·L¯1Na2SO4液含有0.1NA个SO42-
D.常温常压下,22.4L氯气与足量镁粉充分反应,生成MgBr2 2NA
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-=BaSO4↓
B.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+ H2O + CO2=" HClO" + CO32-
C.向氯化铝溶液中通入过量氨气:Al3++4OH-=AlO2-+2H2O
D.过氧化钠与冷水反应:2Na2O2+ 2H2O = 4Na++ 4OH-+ O2↑
难度: 简单查看答案及解析
-
右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:R>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物具有挥发性
D.Z能和Y的最高价氧化物对应的水化物反应
难度: 简单查看答案及解析
-
向27.2g Cu和Cu2O(物质的量之比为2︰1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 。在所得溶液中加入1.0 mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是
A.混合物中Cu的物质的量为0.2 mol
B.产生的NO在标准状况下的体积为4.48L
C.硝酸的物质的量浓度为2.6mol/L
D.Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 简单查看答案及解析