-
烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是
A. 4—甲基—3—丙基戊烷 B. 3—异丙基己烷
C. 2—甲基—3—丙基戊烷 D. 2—甲基—3—乙基己烷
难度: 中等查看答案及解析
-
化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
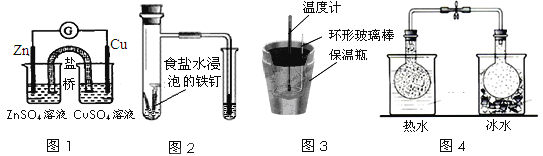
A. 图1:根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的活泼性
B. 图2:可根据小试管中液面的变化判断铁钉发生了析氢腐蚀
C. 图3:根据温度计读数的变化可测量浓硫酸和NaOH反应的中和热
D. 图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)
N2O4(g)是一个吸热反应
难度: 中等查看答案及解析
-
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )

A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1<P2)条件下甲醇百分含量随温度变化的情况
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是

B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
难度: 困难查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是
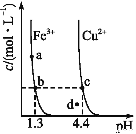
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
难度: 困难查看答案及解析
-
如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液 , 根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-;HA-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
难度: 中等查看答案及解析
-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( )
A. 蒸馏 B. 干馏 C. 升华 D. 萃取
难度: 简单查看答案及解析
-
当前在人类已知的化合物中,种类最多的是( )
A. ⅠA族元素的化合物 B. ⅣA族元素的化合物
C. ⅥA族元素的化合物 D. ⅥB族元素的化合物
难度: 简单查看答案及解析
-
相同质量的下列各种烃,完全燃烧消耗V(O2)【同温同压】最多的是( )
A. CH4 B. C2H4 C. C2H2 D. C6H6
难度: 中等查看答案及解析
-
不能直接用乙烯为原料制取的物质是( )
A. CH3CH2Cl B. CH2Cl-CH2Cl C.
D.
难度: 简单查看答案及解析
-
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
① 分子中具有7个碳原子的芳香烃 ② 分子中具有4个碳原子的烷烃
③ 分子中具有l2个氢原子的烷烃 ④ 分子中具有6个碳原子的烷烃
⑤ 分子中具有8个碳原子的烷烃
A. ①②③ B. ③⑤ C. ③④⑤ D. ②③④⑤
难度: 中等查看答案及解析
-
已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮.如:
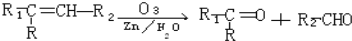 ,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构共有( )种
,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构共有( )种A. 4 B. 5 C. 6 D. 7
难度: 中等查看答案及解析
-
已知甲苯的结构简式为
,其二氯代物的同分异构体有( )
A. 7种 B. 8种 C. 9种 D. 10种
难度: 中等查看答案及解析
-
X、Y两种有机物的分子式不同,但均含有C、H或C、H、O元素,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时耗氧量和生成水的物质的量也不变.则下列有关判断正确的是( )
A. X、Y分子式中氢原子数不一定相同,碳原子数一定不同
B. X、Y分子式中碳原子数一定相同,氢原子数一定不同
C. 若X为CH4,则相对分子质量最小的Y是乙酸或甲酸甲酯
D. 若X为C2H6,则相对分子质量最小的Y的同分异构体只有2种
难度: 中等查看答案及解析
-
有三种有机物的分子式均为C8H8,其键线式分别表示为 X:
,Y:
,Z:
。下列说法正确的是:
A. X、Y、Z都能发生氧化反应,X和Z还能发生加聚反应
B. X、Z分子中所有原子一定在同一平面内
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目相同
D. X、Y、Z都能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图.下列有关说法错误的是( )

A. 操作①用到的玻璃仪器主要有分液漏斗、烧杯
B. 工业制备无水E物质的方法是在E中加生石灰后进行操作②
C. 试剂b可用硫酸
D. 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸
难度: 中等查看答案及解析
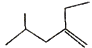 的系统命名_____________________________________。
的系统命名_____________________________________。