-
化学与生活生产、环境保护、资源利用、能源开发等密切相关。下列说法不正确的是
A.实施“雨污分流”工程,可提高水资源的利用率
B.煤的气化、液化是使煤变成清洁能源的有效途径
C.垃圾分类有利于资源回收利用,废易拉罐属不可再生废物
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.CO2分子比例模型:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:131 53I
D.过氧化氢的电子式:H+
H
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B.常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2 NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能够大量共存的是
A.在含有大量HCO3―的溶液中:Na+、NO3-、Cl-、AlO2-
B.加铝粉放出大量H2的溶液中:K+、NH4+、SO42-、Br-
C.含0.1mol·L—1NO3-的溶液:H+、Fe2+、Mg2+、Cl-
D.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏
D.钠的金属性比钾强,工业上用钠制取钾(Na+KCl
K↑+NaCl)
难度: 简单查看答案及解析
-
X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
A.原子半径由小到大的顺序为:X<Z<Y<W
B.Y元素最高价氧化物对应的水化物化学式为H3YO4
C.X、Z两种元素的氧化物中所含化学键类型相同
D.Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是
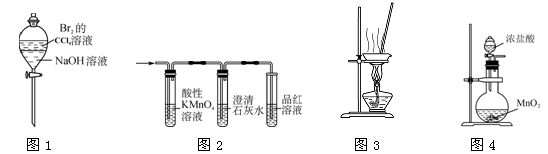
A.图1装置可以用于除去溶解在CCl4中的Br2
B.实验室用图2装置检验制得的乙烯中是否混有SO2和CO2
C.用图3装置在蒸发皿中灼烧CuSO4·5H2O晶体以除去结晶水
D.实验室常用图4装置制取少量氯气
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+H+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O= 2Al(OH)3↓+CO32-
D.Ca(HCO3)2与过量 Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 困难查看答案及解析
-
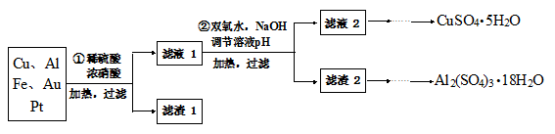
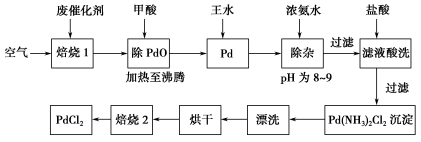
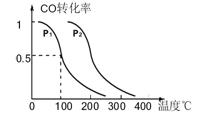
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
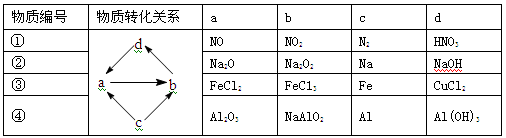
A.①②③ B.③④ C.①③④ D.②④
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
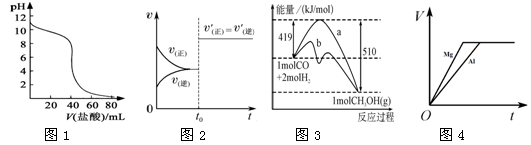
A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
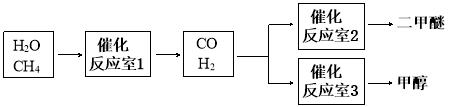
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
难度: 中等查看答案及解析
-
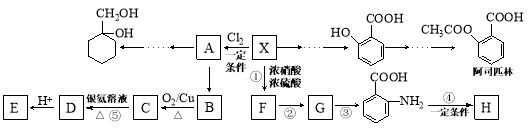
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元——苯并呋喃(Z),W是中间产物(R1、R2均为烃基)。则下列有关叙述不正确的是
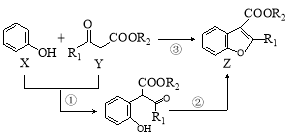
A.反应①属于取代反应
B.仅使用溴水或FeCl3溶液不能鉴别X和W
C.W中没有手性碳原子
D.X、Y、W、Z都能与NaOH溶液反应、都能使酸性高锰酸钾褪色
难度: 简单查看答案及解析
-
下列化学实验事实及其解释或结论都正确的是
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+。
B.取少量卤代烃Y在碱性溶液中水解后再用硝酸酸化,再滴加AgNO3溶液,生成白色沉淀,说明卤代烃中含有氯原子。
C.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物Y,加热后未出现砖红色沉淀,说明Y中不含有醛基。
D.向浓度均为0.1 mol·L—1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。
难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是
A.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,pH值的大小关系:②>①>③
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
C.常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol·L-1
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
难度: 困难查看答案及解析
-
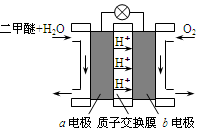
全钒液流电池是一种新型的绿色环保储能电池,工作原理如图所示,a、b均为惰性电极,放电时左槽溶液颜色由黄色变为蓝色。下列叙述正确的是
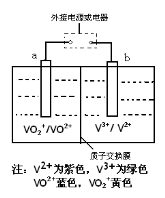
A.充电时右槽溶液颜色由紫色变为绿色
B.放电时,b极发生还原反应
C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O
D.电池的总反应可表示为:VO2++V2++2H+
VO2++V3++H2O
难度: 中等查看答案及解析
-
向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g)
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示
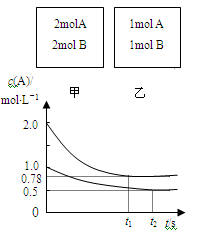
下列说法正确的是
A.x不可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲) <K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L
难度: 困难查看答案及解析